RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
![]() Ce médicament fait l’objet d’une surveillance supplémentaire qui permettra l’identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté. Voir rubrique 4.8 pour les modalités de déclaration des effets indésirables.
Ce médicament fait l’objet d’une surveillance supplémentaire qui permettra l’identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté. Voir rubrique 4.8 pour les modalités de déclaration des effets indésirables.
1. DÉNOMINATION DU MÉDICAMENT
Evrenzo 20 mg comprimés pelliculés
Evrenzo 50 mg comprimés pelliculés
Evrenzo 70 mg comprimés pelliculés
Evrenzo 100 mg comprimés pelliculés
Evrenzo 150 mg comprimés pelliculés
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Evrenzo 20 mg comprimés pelliculés
Chaque comprimé contient 20 mg de roxadustat.
Evrenzo 50 mg comprimés pelliculés
Chaque comprimé contient 50 mg de roxadustat.
Evrenzo 70 mg comprimés pelliculés
Chaque comprimé contient 70 mg de roxadustat.
Evrenzo 100 mg comprimés pelliculés
Chaque comprimé contient 100 mg de roxadustat.
Evrenzo 150 mg comprimés pelliculés
Chaque comprimé contient 150 mg de roxadustat.
Excipient(s) à effet notoire :
Chaque comprimé pelliculé de 20 mg contient 40,5 mg de lactose, 0,9 mg de laque d’aluminium rouge Allura AC et 0,21 mg de lécithine de soja.
Chaque comprimé pelliculé de 50 mg contient 101,2 mg de lactose, 1,7 mg de laque d’aluminium rouge Allura AC et 0,39 mg de lécithine de soja.
Chaque comprimé pelliculé de 70 mg contient 141,6 mg de lactose, 2,1 mg de laque d’aluminium rouge Allura AC et 0,47 mg de lécithine de soja.
Chaque comprimé pelliculé de 100 mg contient 202,4 mg de lactose, 2,8 mg de laque d’aluminium rouge Allura AC et 0,63 mg de lécithine de soja.
Chaque comprimé pelliculé de 150 mg contient 303,5 mg de lactose, 3,7 mg de laque d’aluminium rouge Allura AC et 0,84 mg de lécithine de soja.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Comprimés pelliculés (comprimés).
Evrenzo 20 mg comprimés
Comprimés rouges, ovales (d’environ 8 mm × 4 mm) portant l’inscription « 20 » sur une face.
Evrenzo 50 mg comprimés
Comprimés rouges, ovales (d’environ 11 mm × 6 mm) portant l’inscription « 50 » sur une face.
Evrenzo 70 mg comprimés
Comprimés rouges, ronds (d’environ 9 mm) portant l’inscription « 70 » sur une face.
Evrenzo 100 mg comprimés
Comprimés rouges, ovales (d’environ 14 mm × 7 mm) portant l’inscription « 100 » sur une face.
Evrenzo 150 mg comprimés
Comprimés rouges, en forme d’amande (d’environ 14 mm × 9 mm) portant l’inscription « 150 » sur une face.
4. INFORMATIONS CLINIQUES
4.1 Indications thérapeutiques
Evrenzo est indiqué dans le traitement des patients adultes présentant une anémie symptomatique associée à une maladie rénale chronique (MRC).
4.2 Posologie et mode d’administration
Le traitement par roxadustat doit être instauré par un médecin expérimenté dans la prise en charge de l’anémie. Toutes les autres causes d’anémie doivent être évaluées avant le début du traitement par Evrenzo et lors de la décision d’augmenter la dose.
Les symptômes et les séquelles de l’anémie peuvent varier en fonction de l’âge, du sexe et du fardeau de la maladie ; l’évaluation par un médecin de l’évolution et de l’état cliniques du patient est nécessaire. Outre la présence de symptômes d’anémie, des critères tels que la rapidité de la chute de la concentration en hémoglobine (Hb), la réponse antérieure à un traitement à base de fer et le risque de devoir recourir à une transfusion de globules rouges (GR), peuvent avoir un intérêt dans l’évaluation de l’évolution et de l’état cliniques du patient.
Posologie
La dose adéquate de roxadustat doit être prise par voie orale trois fois par semaine lors de jours non-consécutifs.
La dose doit être individualisée afin de parvenir à des taux d’Hb cibles de 10 à 12 g/dL et de les maintenir, comme décrit ci-dessous.
Le traitement par roxadustat ne doit pas être poursuivi au-delà de 24 semaines si une augmentation cliniquement significative des taux d'Hb n'est pas atteinte. Il convient alors de rechercher d’autres causes d’une réponse inadéquate et de les traiter avant de reprendre Evrenzo.
Dose initiale lors de l’instauration du traitement
Il convient de s’assurer que les réserves en fer sont suffisantes avant d’instaurer le traitement.
Patients n’étant pas en cours de traitement par un agent stimulant l’érythropoïèse (ASE)
Pour les patients qui débutent le traitement de leur anémie et qui n’ont pas été traités auparavant par un ASE, la dose initiale recommandée de roxadustat est de 70 mg trois fois par semaine chez les patients pesant moins de 100 kg et de 100 mg trois fois par semaine chez les patients pesant 100 kg et plus.
Patients en cours de traitement par un ASE
Le traitement des patients actuellement sous ASE peut être changé par un traitement par roxadustat. Toutefois, le changement de traitement des patients dialysés stables sous traitement par un ASE ne doit être envisagé que s’il existe une raison clinique valable (voir rubriques 4.4 et 5.1).
Le changement de traitement des patients non dépendants de la dialyse et stables sous traitement par un ASE n’a pas été étudié. La décision de traiter ces patients par roxadustat doit être basée sur l’évaluation du rapport bénéfice-risque pour chaque patient.
La dose initiale recommandée de roxadustat est basée sur la dose moyenne d’ASE prescrite au cours des 4 semaines précédant ce changement (voir le tableau 1).
La première dose de roxadustat doit remplacer la prochaine dose programmée de l’ASE actuel.
Table 1. Doses initiales de roxadustat à prendre trois fois par semaine suivant la dose d’ASE sous laquelle était le patient
Dose de darbépoétine alfa par voie intraveineuse ou sous-cutanée (microgrammes/semaine) | Dose d’époétine par voie intraveineuse ou sous-cutanée (UI/semaine) | Dose de méthoxy polyéthylène glycol-époétine bêta par voie intraveineuse ou sous-cutanée (microgrammes/mois) | Dose de roxadustat (milligrammes trois fois par semaine) |
Inférieure à 25 | Inférieure à 5 000 | Inférieure à 80 | 70 |
De 25 à inférieure à 40 | De 5 000 à 8 000 | De 80 à 120 inclus | 100 |
De 40 à 80 inclus | Supérieure à 8 000 et jusqu’à 16 000 inclus | Supérieure à 120 et jusqu’à 200 inclus | 150 |
Supérieure à 80 | Supérieure à 16 000 | Supérieure à 200 | 200 |
ASE : agent stimulant l’érythropoïèse
Adaptation posologique et surveillance du taux d’Hb
La dose d’entretien individualisée est comprise entre 20 mg et 400 mg trois fois par semaine (voir la rubrique dose maximale recommandée). Les taux d’Hb doivent être contrôlés toutes les deux semaines jusqu’à l’obtention du taux cible compris entre 10 et 12 g/dL et sa stabilisation, puis toutes les 4 semaines, ou selon la pertinence clinique.
La dose de roxadustat peut être augmentée ou diminuée progressivement (par paliers) à partir de la dose initiale, 4 semaines après le début du traitement, puis toutes les 4 semaines, sauf si le taux d’Hb augmente de plus de 2 g/dL, auquel cas la dose doit être immédiatement diminuée d’un palier. Lors de l’adaptation de la posologie de roxadustat, il convient de tenir compte du taux d’Hb actuel et de la variation de ce taux au cours des 4 dernières semaines, et de suivre les paliers d’adaptation posologique conformément à l’algorithme décrit dans le tableau 2.
Les adaptations de la posologie par paliers doivent suivre la séquence des doses disponibles :
20 mg ‑ 40 mg ‑ 50 mg ‑ 70 mg ‑ 100 mg ‑ 150 mg ‑ 200 mg ‑ 250 mg ‑ 300 mg ‑ 400 mg (ce dernier palier (400 mg) n’est valable que pour les patients dialysés)
Tableau 2. Règles d’adaptation posologique
Variation du taux d’Hb au cours des 4 semaines précédentes* | Taux d’Hb actuel (g/dL) : | |||
Inférieur à 10,5 | De 10,5 à 11,9 | De 12,0 à 12,9 | 13,0 ou supérieur | |
Variation d’une valeur | Pas de changement | Réduire la dose d’un palier | Réduire la dose d’un palier | Suspendre la prise, |
Variation d’une valeur comprise entre | Augmenter la dose d’un palier | Pas de changement | Réduire la dose d’un palier | |
Variation d’une valeur | Augmenter la dose d’un palier | Augmenter la dose d’un palier | Pas de changement | |
La dose de roxadustat ne doit pas être ajustée plus fréquemment qu’une fois toutes les 4 semaines, sauf si le taux d’Hb augmente de plus de 2 g/dL à tout moment dans une période de 4 semaines, auquel cas la dose doit être immédiatement diminuée d’un palier.
*Variation du taux d’hémoglobine (Hb) sur la période précédente de 4 semaines = (valeur Hb actuelle) – (valeur Hb précédente obtenue 4 semaines auparavant).
S’il est nécessaire de diminuer la dose d’un patient recevant déjà la dose la plus faible (20 mg trois fois par semaine), ne pas réduire la dose de 20 mg en cassant le comprimé, mais diminuer la fréquence des prises à deux fois par semaine. Si une nouvelle réduction de la dose est requise, la fréquence des prises peut être à nouveau réduite à une fois par semaine.
Dose d’entretien
Après stabilisation du taux d’Hb dans la cible entre 10 et 12 g/dL, la surveillance des taux d’Hb doit être poursuivie régulièrement et les règles d’adaptation posologique suivies (voir tableau 2).
Patients débutant une dialyse pendant le traitement par roxadustat
Aucune adaptation posologique particulière n’est nécessaire pour les patients atteints d’une MRC qui débutent une dialyse pendant leur traitement par roxadustat. Les règles normales d’adaptation posologique (voir tableau 2) doivent être suivies.
Traitement concomitant par roxadustat et par inducteurs ou inhibiteurs enzymatique
Lors de l’instauration ou de l’interruption d’un traitement concomitant par de puissants inhibiteurs (ex. gemfibrozil) ou inducteurs (ex. rifampicine) du CYP2C8, ou inhibiteurs de l’UGT1A9 (ex. probénécide) : les taux d’Hb doivent être surveillés régulièrement et les règles d’adaptation posologique suivies (voir tableau 2 ; voir également les rubriques 4.5 et 5.2).
Dose maximale recommandée
Patients non dialysés ne pas dépasser une dose de roxadustat de 3 mg/kg ou de 300 mg trois fois par semaine, la dose la plus faible étant retenue.
Patients dialysés ne pas dépasser une dose de roxadustat de 3 mg/kg ou de 400 mg trois fois par semaine, la dose la plus faible étant retenue.
Omission de prise
Si une dose est oubliée et si l’intervalle restant avant la dose suivante prévue est supérieur à 24 heures, la dose omise doit être prise dès que possible.
Si l’intervalle restant avant la dose suivante prévue est inférieur ou égal à 24 heures, la dose oubliée ne doit pas être prise et la dose suivante doit être prise le jour prévu. Dans chaque cas, le calendrier normal des prises doit reprendre par la suite.
Populations particulières
Personne âgée
Aucune adaptation de la posologie initiale n’est nécessaire chez les patients âgés (voir rubrique 5.2).
Patients présentant une insuffisance hépatique
En cas d’insuffisance hépatique légère (Child‑Pugh classe A), aucune adaptation de la posologie initiale n’est nécessaire (voir rubriques 4.4 et 5.2).
En cas d’insuffisance hépatique modérée, la prudence est de mise. La dose initiale doit être réduite de moitié ou arrondie à la dose la plus proche de la moitié lors de l’instauration du traitement chez des patients présentant une insuffisance hépatique modérée (Child‑Pugh classe B).
En cas d’insuffisance hépatique sévère (Child-Pugh classe C), l’utilisation d’Evrenzo n’est pas recommandée car la sécurité et l’efficacité n’ont pas été évaluées dans cette population (voir rubriques 4.4 et 5.2).
Population pédiatrique
La sécurité et l’efficacité du roxadustat chez les patients âgés de moins de 18 ans n’ont pas été établies. Aucune donnée n’est disponible.
Mode d’administration
Les comprimés pelliculés d’Evrenzo doivent être pris par voie orale avec ou sans nourriture. Les comprimés doivent être avalés entiers et non mâchés, cassés ou écrasés, en l’absence de données cliniques dans ces conditions, et afin de protéger le noyau photosensible du comprimé d’une photodégradation.
Les comprimés doivent être pris au moins 1 heure après l’administration de chélateurs du phosphate (à l’exception du lanthane) ou d’autres médicaments contenant des cations multivalents tels que le calcium, le fer, le magnésium ou l’aluminium (voir rubriques 4.5 et 5.2).
4.3 Contre-indications
Evrenzo est contre-indiqué dans les situations suivantes :
- Hypersensibilité à la substance active, à l‘arachide, au soja ou à l’un des excipients mentionnés à la rubrique 6.1.
- Troisième trimestre de la grossesse (voir rubriques 4.4 et 4.6).
- Allaitement (voir rubrique 4.6).
4.8 Effets indésirables
Résumé du profil de sécurité
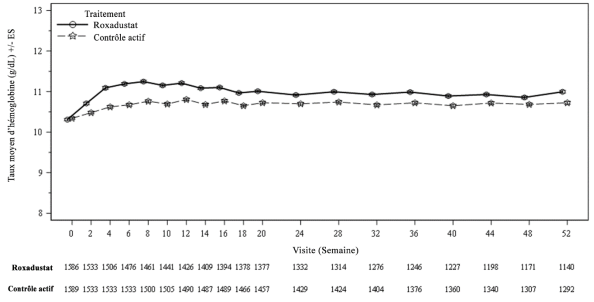
La sécurité d’Evrenzo a été évaluée chez 3 542 patients non dépendants de la dialyse (NDD) et 3 353 patients dépendants de la dialyse (DD) présentant une anémie et une MRC, qui ont reçu au moins une dose de roxadustat.
Les effets indésirables les plus fréquents (≥ 10 %) associés au roxadustat sont l’hypertension (13,9 %), la thrombose de l’accès vasculaire (12,8 %), la diarrhée (11,8 %), l’œdème périphérique (11,7 %), l’hyperkaliémie (10,9 %) et la nausée (10,2 %).
Les effets indésirables graves les plus fréquents (≥ 1 %) associés au roxadustat ont été le sepsis (3,4 %), l’hyperkaliémie (2,5 %), l’hypertension (1,4 %) et la thrombose veineuse profonde (1,2 %).
Liste tabulée des effets indésirables
Les effets indésirables observés au cours des études cliniques et/ou de l’expérience post-commercialisation sont répertoriés dans cette rubrique par catégorie de fréquence.
Les catégories de fréquence sont définies comme suit : très fréquent (≥ 1/10) ; fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1 000, < 1/100) ; rare (≥ 1/10 000, < 1/1 000) ; très rare (< 1/10 000) ; fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Tableau 3. Effets indésirables
Classe de systèmes d’organes MedDRA (SOC) | Catégorie de fréquence | Effet indésirable | |
Infections et infestations | Fréquent | Sepsis | |
Affections hématologiques et du système lymphatique | Fréquent | Thrombocytopénie | |
Affections endocriniennes | Fréquence indéterminée | Hypothyroïdie secondaire | |
Troubles du métabolisme et de la nutrition | Très fréquent | Hyperkaliémie | |
Affections psychiatriques | Fréquent | Insomnie | |
Affections du système nerveux | Fréquent | Convulsions, céphalée | |
Peu fréquent | Infarctus cérébral | ||
Affections vasculaires | Très fréquent | Hypertension, thrombose de l’accès vasculaire (TAV)1 | |
Fréquent | Thrombose veineuse profonde (TVP) | ||
Affections respiratoires, thoraciques et médiastinales | Peu fréquent | Embolie pulmonaire | |
Affections gastro-intestinales | Très fréquent | Nausée, diarrhée | |
Fréquent | Constipation, vomissement | ||
Affections hépatobiliaires | Peu fréquent | Hyperbilirubinémie | |
Affections de la peau et du tissu sous-cutané | Fréquence indéterminée | Dermatite exfoliative généralisée (DEG) | |
Troubles généraux et anomalies au site d’administration | Très fréquent | Œdème périphérique | |
Investigations | Fréquence indéterminée | Diminution des taux sanguins de thyréostimuline (TSH), augmentation du taux sanguin de cuivre | |
1Cet effet indésirable est associé aux patients atteints d’une MRC qui étaient dialysés pendant leur traitement par roxadustat. | |||
Description de certains effets indésirables
Évènements vasculaires thrombotiques
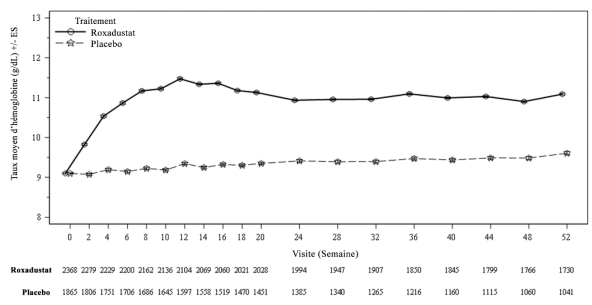
Chez les patients atteints d’une MRC NDD, les événements de TVP ont été peu fréquents et sont survenus chez 1,0 % (0,6 patient avec évènements sur 100 patient-années d’exposition) dans le groupe roxadustat, et chez 0,2 % (0,2 patient avec évènements sur 100 patient-années d’exposition) dans le groupe placebo. Chez les patients atteints d’une MRC DD, les évènements de TVP sont survenus chez 1,3 % (0,8 patient avec évènements sur 100 patient-années d’exposition) dans le groupe roxadustat, et chez 0,3 % (0,1 patient avec évènements sur 100 patient-années d’exposition) dans le groupe ASE (voir rubrique 4.4).
Chez les patients atteints d’une MRC NDD, une embolie pulmonaire a été observée chez 0,4 % (0,2 patient avec évènements sur 100 patient-années d’exposition) dans le groupe roxadustat, comparativement à 0,2 % (0,1 patient avec évènements sur 100 patient-années d’exposition) dans le groupe placebo. Chez les patients atteints d’une MRC DD, une embolie pulmonaire a été observée chez 0,6 % (0,3 patient avec évènements sur 100 patient-années d’exposition) dans le groupe roxadustat, comparativement à 0,5 % (0,3 patient avec évènements sur 100 patient-années d’exposition) dans le groupe ASE (voir rubrique 4.4).
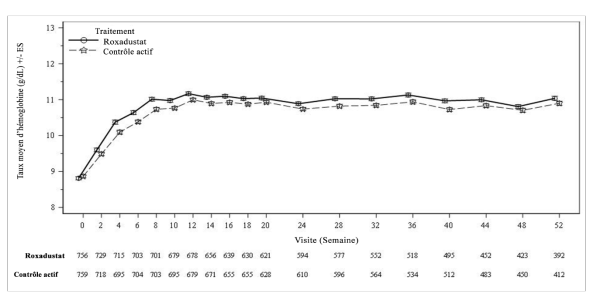
Chez les patients atteints d’une MRC DD, une thrombose de l’accès vasculaire a été observée chez 12,8 % (7,6 patients avec évènements sur 100 patient-années d’exposition) dans le groupe roxadustat, comparativement à 10,2 % (5,4 patients avec évènements sur 100 patient-années d’exposition) dans le groupe ASE (voir rubrique 4.4).
Chez les patients atteints d’une MRC NDD, l’incidence globale d’évènements de troubles vasculaires ischémiques du système nerveux central était plus élevée dans le groupe roxadustat (3,9 %) que dans le groupe placebo (2,4 %) et le taux d’incidence ajusté lors du suivi était plus élevé dans le groupe roxadustat (2,3) que dans le groupe placebo (1,8). La survenue d’infarctus cérébraux était plus élevée de 0,2 % dans le groupe roxadustat que dans le groupe placebo (0,6 % vs 0,4 %).
Chez les patients atteints d’une MRC DD, l’incidence globale d’évènements de troubles vasculaires ischémiques du système nerveux central était similaire dans le groupe roxadustat (4,8 %) et dans le groupe contrôle actif (4,2 %). Le taux d’incidence sur 100 patient-années d’exposition était de 2,8 dans le groupe roxadustat contre 2,2 dans le groupe contrôle actif. La survenue d’accidents vasculaires cérébraux ischémiques était plus élevée de 0,2 % dans le groupe roxadustat que dans le groupe comparateur actif (0,8 % vs 0,6 %).
Convulsions
Chez les patients atteints d’une MRC NDD, des convulsions sont survenues chez 1,1 % (0,6 patient avec évènements sur 100 patient-années d’exposition) dans le groupe roxadustat, et chez 0,2 % (0,2 patient avec évènements sur 100 patient-années d’exposition) dans le groupe placebo (voir rubrique 4.4).
Chez les patients atteints d’une MRC DD, des convulsions sont survenues chez 2,0 % (1,2 patient avec évènements sur 100 patient-années d’exposition) dans le groupe roxadustat, et chez 1,6 % (0,8 patient avec évènements sur 100 patient-années d’exposition) dans le groupe ASE (voir rubrique 4.4).
Sepsis
Chez les patients atteints d’une MRC NDD, un sepsis a été observé chez 2,1 % (1,3 patient avec évènements sur 100 patient-années d’exposition) dans le groupe roxadustat, comparativement à 0,4 % (0,3 patient avec évènements sur 100 patient-années d’exposition) dans le groupe placebo. Chez les patients dialysés, un sepsis a été observé chez 3,4 % (2,0 patients avec évènements sur 100 patient-années d’exposition) dans le groupe roxadustat, comparativement à 3,4 % (1,8 patient avec évènements sur 100 patient-années d’exposition) dans le groupe ASE (voir rubrique 4.4).
Réactions cutanées
La dermatite exfoliative généralisée, faisant partie des effets indésirables cutanés sévères (SCAR), a été rapportée au cours de la surveillance post-commercialisation et a montré un lien avec le traitement par roxadustat (fréquence inconnue).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration.
Belgique
Agence fédérale des médicaments et des produits de santé
www.afmps.be
Division Vigilance:
Site internet: www.notifieruneffetindesirable.be
e-mail: adr@fagg-afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy ou Division de la
pharmacie et des médicaments de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHÉ
Astellas Pharma Europe B.V.
Sylviusweg 62
2333 BE Leiden
Pays-Bas
8. NUMÉRO(S) D’AUTORISATION DE MISE SUR LE MARCHÉ
12 x 1 comprimés pelliculés
EU/1/21/1574/001 – 005
36 x 1 comprimés pelliculés
EU/1/21/1574/006 – 010
10. DATE DE MISE À JOUR DU TEXTE
17/09/2025
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments https://www.ema.europa.eu.
1
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 4386942 | EVRENZO 20MG COMPR PELLIC 12 x 1 | € 52,15 | - | Oui | € 2 | € 1 | |
| 4386959 | EVRENZO 50MG COMPR PELLIC 12 x 1 | € 116,72 | - | Oui | € 2 | € 1 | |
| 4386975 | EVRENZO 70MG COMPR PELLIC 12 x 1 | € 159,02 | - | Oui | € 2 | € 1 | |
| 4386967 | EVRENZO 100MG COMPR PELLIC 12 x 1 | € 222,47 | - | Oui | € 2 | € 1 | |
| 4386983 | EVRENZO 150MG COMPR PELLIC 12 x 1 | € 328,22 | - | Oui | € 2 | € 1 |