1. DÉNOMINATION DU MÉDICAMENT
Rybelsus 3 mg comprimés
Rybelsus 7 mg comprimés
Rybelsus 14 mg comprimés
Rybelsus 25 mg comprimés
Rybelsus 50 mg comprimés
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Rybelsus 3 mg comprimés
Chaque comprimé contient 3 mg de sémaglutide*.
Rybelsus 7 mg comprimés
Chaque comprimé contient 7 mg de sémaglutide*.
Rybelsus 14 mg comprimés
Chaque comprimé contient 14 mg de sémaglutide*.
Rybelsus 25 mg comprimés
Chaque comprimé contient 25 mg de sémaglutide*.
Rybelsus 50 mg comprimés
Chaque comprimé contient 50 mg de sémaglutide*.
*analogue du glucagon-like peptide-1 humain (GLP-1) produit dans des cellules Saccharomyces cerevisiae par la technique de l’ADN recombinant.
Excipient à effet notoire
Chaque comprimé, quel que soit le dosage du sémaglutide, contient 23 mg de sodium.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Comprimé
Rybelsus 3 mg comprimés
Comprimé ovale, blanc à jaune pâle (7,5 mm x 13,5 mm), gravé « 3 » sur une face et « novo » sur l’autre face.
Rybelsus 7 mg comprimés
Comprimé ovale, blanc à jaune pâle (7,5 mm x 13,5 mm), gravé « 7 » sur une face et « novo » sur l’autre face.
Rybelsus 14 mg comprimés
Comprimé ovale, blanc à jaune pâle (7,5 mm x 13,5 mm), gravé « 14 » sur une face et « novo » sur l’autre face.
Rybelsus 25 mg comprimés
Comprimé ovale, blanc à jaune pâle (6,8 mm x 12 mm), gravé « 25 » sur une face et « novo » gravée sur l’autre face.
Rybelsus 50 mg comprimés
Comprimé ovale, blanc à jaune pâle (6,8 mm x 12 mm), gravé « 50 » sur une face et « novo » gravée sur l’autre face.
4. INFORMATIONS CLINIQUES
4.1 Indications thérapeutiques
Rybelsus est indiqué chez les adultes pour le traitement du diabète de type 2 insuffisamment contrôlé en complément d’un régime alimentaire et d’une activité physique afin d'améliorer le contrôle glycémique :
• en monothérapie, quand l’utilisation de la metformine est considérée comme inappropriée en raison d’une intolérance ou de contre-indications
• en association avec d’autres médicaments destinés au traitement du diabète.
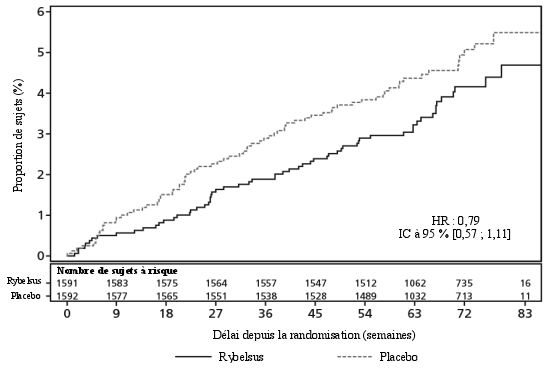
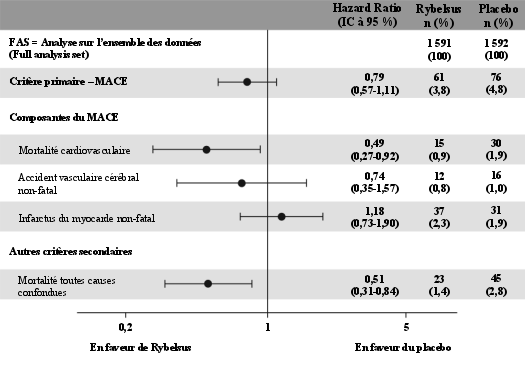
Pour les résultats des études concernant les associations, les effets sur le contrôle glycémique et les événements cardiovasculaires, ainsi que sur les populations étudiées, voir les rubriques 4.4, 4.5 et 5.1.
4.2 Posologie et mode d’administration
Posologie
La dose initiale de sémaglutide est de 3 mg une fois par jour pendant un mois. Après un mois de traitement, la dose devra être augmentée à une dose d’entretien de 7 mg une fois par jour. Si nécessaire, la dose peut être augmentée au palier supérieur après au moins un mois de traitement à la dose actuelle. La dose quotidienne unique recommandée est de 7 mg, 14 mg, 25 mg et 50 mg.
La dose quotidienne unique maximum recommandée de sémaglutide est de 50 mg. Rybelsus doit toujours être utilisé à raison d’un comprimé par jour. Ne pas prendre plus d’un comprimé par jour pour obtenir l’effet d’une dose plus importante.
Transition entre l'administration orale et sous-cutanée
L'effet du passage du sémaglutide oral à sous cutané n'est pas facilement prévisible car le sémaglutide oral présente une variabilité pharmacocinétique en termes d’absorption plus importante que celle du sémaglutide sous cutané.
Les patients traités par 0,5 mg de sémaglutide sous cutané une fois par semaine peuvent effectuer la transition vers le sémaglutide oral 7 mg ou 14 mg une fois par jour.
Les patients traités par 1 mg de sémaglutide sous cutané une fois par semaine peuvent effectuer la transition vers le sémaglutide oral 14 mg ou 25 mg une fois par jour.
Les patients traités par 2 mg de sémaglutide sous cutané une fois par semaine peuvent effectuer la transition vers le sémaglutide oral 25 mg ou 50 mg une fois par jour.
Les patients peuvent débuter le sémaglutide oral (Rybelsus) une semaine après leur dernière dose de sémaglutide sous cutané
Lorsque le sémaglutide est utilisé en association à la metformine et/ou à un inhibiteur du co-transporteur de sodium-glucose de type 2 (iSGLT2) ou à la thiazolidinedione, le traitement par metformine et/ou iSGLT2 ou thiazolidinedione peut être poursuivi à la même dose.
Lorsque le sémaglutide est utilisé en association à un traitement par sulfamide hypoglycémiant ou par insuline, une diminution de la dose du sulfamide hypoglycémiant ou de l’insuline pourra être envisagée afin de réduire le risque d’hypoglycémie (voir rubriques 4.4 et 4.8).
Il n’est pas nécessaire de réaliser une auto-surveillance glycémique pour ajuster la dose du sémaglutide. Une autosurveillance glycémique est nécessaire afin d’ajuster la dose du sulfamide hypoglycémiant et de l’insuline, particulièrement au moment de l’initiation par le sémaglutide et de la réduction de la dose d’insuline. Il est recommandé que cette diminution d’insuline soit réalisée de manière progressive.
Oubli de dose
Si une dose est oubliée, elle ne doit pas être prise, et la dose suivante doit être prise le lendemain.
Sujets âgés
Aucun ajustement de la dose n’est nécessaire en fonction de l’âge. L’expérience clinique de ce traitement chez les patients ≥ 75 ans est limitée (voir rubrique 5.2).
Insuffisance rénale
Aucun ajustement de la dose n’est nécessaire chez les patients présentant une insuffisance rénale légère, modérée ou sévère. L’expérience relative à l’utilisation du sémaglutide chez des patients présentant une insuffisance rénale sévère est limitée. Le sémaglutide n’est pas recommandé chez les patients présentant une insuffisance rénale au stade terminal (voir rubrique 5.2).
Insuffisance hépatique
Aucun ajustement de la dose n’est nécessaire chez les patients présentant une insuffisance hépatique. L’expérience relative à l’utilisation du sémaglutide chez des patients présentant une insuffisance hépatique sévère est limitée. Il convient d’être prudent lors du traitement de ces patients avec le sémaglutide (voir rubrique 5.2).
Population pédiatrique
La sécurité et l’efficacité de Rybelsus chez les enfants et les adolescents âgés de moins de 18 ans n’ont pas été établies. Aucune donnée n’est disponible.
Mode d’administration
Rybelsus est un comprimé pour administration par voie orale une fois par jour.
– Ce médicament doit être pris à jeun après une période de jeûne recommandée d’au moins 8 heures (voir rubrique 5.2).
– Il doit être avalé entier avec une gorgée d'eau (jusqu’à un demi-verre d’eau équivalent à 120 ml). Les comprimés ne doivent pas être divisés, écrasés ni mâchés, car l’impact sur l’absorption du sémaglutide est inconnu.
– Les patients doivent attendre au moins 30 minutes avant de manger, de boire ou de prendre d’autres médicaments. Si le délai est inférieur à 30 minutes, l’absorption de sémaglutide est diminuée (voir rubriques 4.5 et 5.2).
4.3 Contre-indications
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.8 Effets indésirables
Résumé du profil de sécurité
Lors de 10 essais de phase 3a, 5 707 patients ont été exposés au sémaglutide seul ou en association à d’autres hypoglycémiants. La durée du traitement allait de 26 à 78 semaines. Les effets indésirables les plus fréquemment rapportés pendant les essais cliniques étaient les affections gastro-intestinales, incluant les nausées (très fréquentes), les diarrhées (très fréquentes) et les vomissements (fréquents).
Liste tabulée des effets indésirables
Le tableau 1 répertorie les effets indésirables rapportés lors des essais de phase 3 (décrits plus en détail à la rubrique 5.1) et dans les rapports post-commercialisation chez les patients diabétiques de type 2. La fréquence des effets indésirables (excepté les complications de la rétinopathie diabétique, et la dysesthésie, voir note du tableau 1) repose sur un ensemble d’essais de phase 3a, excluant l’essai d’évaluation des résultats cardiovasculaires.
Les effets indésirables sont indiqués ci-dessous par classe de systèmes d’organes et par fréquence absolue. Les fréquences sont définies comme suit : très fréquent : (≥ 1/10) ; fréquent : (≥ 1/100, < 1/10) ; peu fréquent : (≥ 1/1 000, < 1/100) ; rare : (≥ 1/10 000, < 1/1 000) ; très rare : (< 1/10 000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles). Au sein de chaque groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
Tableau 1 Fréquence des effets indésirables du sémaglutide oral
Classe de systèmes d’organes MedDRA | Très fréquent | Fréquent | Peu fréquent | Rare | Fréquence indéterminée |
Affections du système immunitaire |
|
| Hypersensibilitéc | Réaction anaphylactique |
|
Troubles du métabolisme et de la nutrition | Hypoglycémie en cas d’utilisation avec de l’insuline ou un sulfamide hypoglycémianta | Hypoglycémie en cas d’utilisation avec d’autres antidiabétiques orauxa |
|
|
|
Affections du système nerveux |
| Vertiges | Dysgueusie |
|
|
Affections oculaires |
| Complications de la rétinopathie diabétiqueb |
|
|
|
Affections cardiaques |
|
| Augmentation de la fréquence cardiaque |
|
|
Affections gastro-intestinales | Nausées | Vomissements | Éructation | Pancréatite aiguë | Occlusion intestinaled,f |
Affections hépatobiliaires |
|
| Lithiase biliaire |
|
|
Troubles généraux et anomalies au site d’administration |
| Fatigue |
|
|
|
Investigations |
| Lipase augmentée | Perte de poids |
|
|
a) Hypoglycémie définie comme une glycémie < 3,0 mmol/l ou < 54 mg/dl.
b) Les complications de la rétinopathie diabétique comprennent : photo-coagulation rétinienne, traitement par des médicaments intravitréens, hémorragie intravitréenne et cécité diabétique (peu fréquent). La fréquence est basée sur l’essai d’évaluation de la sécurité cardiovasculaire conduit sur le sémaglutide sous-cutané, mais on ne peut exclure que le risque de complications de la rétinopathie diabétique identifié s’applique également à Rybelsus.
c) Terme groupé couvrant également les effets indésirables liés à l'hypersensibilité tels que les éruptions cutanées et l'urticaire.
d) D’après les rapports post-commercialisation.
e) La fréquence est basée sur les résultats de l’essai PIONEER PLUS pour les dosages de 25 mg et 50 mg. Veuillez vous référer à la rubrique « Dysesthésie » ci-dessous pour plus d’informations.
f) Terme regroupant les PT (Preferred Terms) « occlusion intestinale », « iléus », « occlusion de l’intestin grêle ».
Description de certains effets indésirables
Hypoglycémie
Les hypoglycémies sévères ont principalement été observées lorsque le sémaglutide était associé à un sulfamide hypoglycémiant (< 0,1 % des patients ; < 0,001 événement/patient-année) ou à l’insuline (1,1 % des patients ; 0,013 événement/patient-année). Peu d’épisodes d’hypoglycémie (0,1 % des patients ; 0,001 événement/patient-année) ont été observés lors de l’administration du sémaglutide en association à des antidiabétiques oraux autres que les sulfamides hypoglycémiants.
Réactions indésirables gastro-intestinales
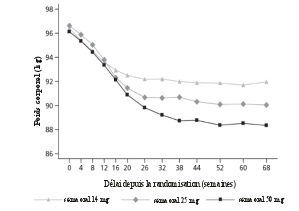
Des nausées sont survenues chez 15 % des patients, des diarrhées chez 10 % et des vomissements chez 7 % des patients lorsqu’ils étaient traités avec du sémaglutide. La plupart de ces événements étaient d’intensité légère à modérée et de courte durée. Les événements ont entraîné un arrêt du traitement chez 4 % des sujets. Les événements étaient plus fréquemment rapportés pendant les premiers mois de traitement.
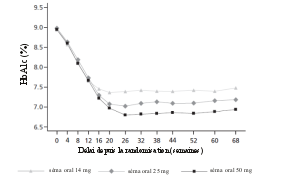
Dans PIONEER PLUS, lors du traitement par sémaglutide 25 mg et 50 mg, des nausées sont survenues respectivement chez 27 % et 27 % des patients, des diarrhées chez 13 % et 14 % des patients et des vomissements chez 17 % et 18 % des patients. Ces événements ont entraîné un arrêt du traitement chez respectivement 6 % et 8 % des patients.
La plupart de ces événements étaient de sévérité légère à modérée et de courte durée. Les événements étaient plus fréquemment rapportés lors de l'augmentation de dose pendant les premiers mois de traitement
Des cas de pancréatites aiguës confirmées par adjudication ont été rapportés dans les essais cliniques de phase 3a pour le sémaglutide (< 0,1 %) et le comparateur (0,2 %). Dans l'essai d’évaluation des résultats cardiovasculaires, la fréquence des pancréatites aiguës confirmées par adjudication était de 0,1 % pour le sémaglutide et de 0,2 % pour le placebo (voir rubrique 4.4).
Complications liées à la rétinopathie diabétique
Un essai clinique sur 2 ans du sémaglutide sous-cutané a étudié 3 297 patients diabétiques de type 2, avec un risque cardiovasculaire élevé, un diabète ancien et un contrôle glycémique insatisfaisant. Lors de cet essai, des événements de complications de la rétinopathie diabétique confirmés par adjudication, sont survenus chez plus de patients traités avec sémaglutide sous-cutané (3,0 %) comparé à ceux sous placebo (1,8 %). Cela a été observé chez des patients insulino-traités avec une rétinopathie diabétique connue. La différence entre les traitements est apparue rapidement et a persisté tout au long de l’essai. L’évaluation systématique des complications de la rétinopathie diabétique n’a été réalisée que dans l’essai d’évaluation des résultats cardiovasculaires avec le sémaglutide sous-cutané. Lors d’essais cliniques avec Rybelsus d’une durée allant jusqu’à 18 mois et portant sur 6 352 patients diabétiques de type 2, les événements indésirables liés à la rétinopathie diabétique ont été rapportés dans des proportions similaires chez des patients traités par sémaglutide (4,2 %) et par les comparateurs (3,8 %).
Immunogénicité
Compte tenu des propriétés immunogènes potentielles des médicaments contenant des protéines ou des peptides, les patients traités par le sémaglutide peuvent développer des anticorps. La proportion de sujets testés positifs aux anticorps anti-sémaglutide à tout moment après l’inclusion était faible (0,5 %) et aucun sujet ne présentait d’anticorps neutralisants anti-sémaglutide ni d’anticorps anti-sémaglutide avec un effet neutralisant sur le GLP-1 endogène à la fin de l’essai.
Augmentation de la fréquence cardiaque
Une augmentation de la fréquence cardiaque a été observée avec les agonistes des récepteurs du GLP-1. Dans les essais de phase 3a, des augmentations moyennes de 0 à 4 battements par minute (bpm) par rapport à une valeur initiale de 69 à 76 bpm ont été observées chez les patients traités avec Rybelsus.
Dysesthésie
Des événements liés à une altération de la sensation cutanée tels qu’une paresthésie, des douleurs cutanées, une sensibilité de la peau, une dysesthésie et une sensation de brûlure cutanée ont été rapportées chez respectivement 2,1 % et 5,2 % des patients traités par sémaglutide oral 25 mg et 50 mg. Les événements étaient de sévérité légère à modérée et la plupart des patients se sont rétablis lors de la poursuite du traitement.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration :
Belgique
Agence fédérale des médicaments et des produits de santé
www.afmps.be
Division Vigilance
Site internet : www.notifieruneffetindesirable.be
E-mail : adr@fagg-afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy ou Division de la pharmacie et des médicaments de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHÉ
Novo Nordisk A/S
Novo Allé
DK-2880 Bagsværd
Danemark
8. NUMÉRO D’AUTORISATION DE MISE SUR LE MARCHÉ
EU/1/20/1430/001
EU/1/20/1430/002
EU/1/20/1430/003
EU/1/20/1430/004
EU/1/20/1430/005
EU/1/20/1430/006
EU/1/20/1430/007
EU/1/20/1430/008
EU/1/20/1430/009
EU/1/20/1430/010
EU/1/20/1430/011
EU/1/20/1430/012
EU/1/20/1430/013
EU/1/20/1430/014
EU/1/20/1430/015
EU/1/20/1430/031
EU/1/20/1430/032
EU/1/20/1430/033
EU/1/20/1430/034
EU/1/20/1430/035
EU/1/20/1430/036
EU/1/20/1430/037
EU/1/20/1430/038
EU/1/20/1430/039
EU/1/20/1430/040
10. DATE DE MISE À JOUR DU TEXTE
05/2025
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments https://www.ema.europa.eu
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’Autorisation de mise sur le marché et fabricant
Novo Nordisk A/S
Novo Allé
DK-2880 Bagsværd
Danemark
La dernière date à laquelle cette notice a été révisée est 05/2025
Autres sources d’informations
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments https://www.ema.europa.eu
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 4213724 | RYBELSUS 3MG COMP 30 | A10BJ06 | € 100,89 | - | Oui | - | - |
| 4216321 | RYBELSUS 7MG COMP 30 | A10BJ06 | € 100,89 | - | Oui | - | - |
| 4216347 | RYBELSUS 14MG COMP 30 | A10BJ06 | € 100,89 | - | Oui | - | - |