RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
1. DÉNOMINATION DU MÉDICAMENT VÉTÉRINAIRE
Prednicure 5 mg comprimés pour chiens et pour chats
4. INFORMATIONS CLINIQUES
4.2 Indications d’utilisation, en spécifiant les espèces cibles
Traitement symptomatique ou traitement d’appoint des maladies inflammatoires et des maladies d’origine immunitaire chez les chiens et les chats.
4.3 Contre-indications
Ne pas utiliser chez les animaux en cas de :
- Infections virales, mycosiques ou parasitaires non contrôlées par un traitement approprié,
- Diabète sucré,
- Hyperadrénocorticisme,
- Ostéoporose,
- Insuffisance cardiaque,
- Insuffisance rénale,
- Ulcère cornéen,
- Ulcères gastro-intestinaux,
- Glaucome.
Ne pas utiliser en même temps que des vaccins vivants atténués.
Ne pas utiliser en cas d'hypersensibilité à la substance active, à d’autres corticostéroïdes ou à l'un des excipients.
Voir aussi rubriques 4.7 et 4.8.
4.8 Interactions médicamenteuses et autres formes d'interactions
La phénytoïne, les barbituriques, l’éphédrine et la rifampicine peuvent accélérer la clairance métabolique des corticostéroïdes, ce qui se traduit par une diminution des concentrations sanguines et de l'effet physiologique du médicament.
L’utilisation concomitante de ce médicament vétérinaire et des médicaments anti-inflammatoires non stéroïdiens peut exacerber l'ulcération du tube digestif.
L’administration de prednisolone peut induire une hypokaliémie et donc, augmenter le risque de toxicité des glycosides cardiotoniques. Le risque d’hypokaliémie peut être augmenté si la prednisolone est administrée en association avec des diurétiques hypokaliémiants.
Des précautions doivent être prises en cas d'utilisation combinée avec de l’insuline.
L’administration de ce médicament vétérinaire peut interférer avec l’efficacité vaccinale. Il convient d’observer un intervalle de deux semaines avant ou après le traitement avant de vacciner avec des vaccins vivants atténués.
4.9 Posologie et voie d'administration
Voie orale.
La dose et la durée totale du traitement, dans la plage des posologies autorisées, sont déterminées au cas par cas par le vétérinaire en fonction de la sévérité des symptômes.
Dose initiale pour les chiens et les chats : 0,5 à 2 mg de prednisolone par kg de poids corporel par jour.
Il peut s’avérer nécessaire d’administrer le médicament à la posologie indiquée ci-dessus pendant une à trois semaines. Pour un traitement plus long : lorsque, à l'issue d'une période d’administration quotidienne, l'effet recherché a été obtenu, la dose doit être réduite jusqu’à atteindre la dose efficace la plus faible. La diminution de la dose doit être effectuée au moyen d'un traitement à jours alternés et/ou en divisant la dose par deux à intervalles de 5 à 7 jours jusqu’à atteindre la dose efficace la plus faible .
Les chiens doivent être traités le matin et les chats le soir afin de coïncider avec le pic de cortisol endogène.
Le tableau ci-dessous sert de guide pour l’administration du produit à la dose minimale de 0,5 mg/kg de poids corporel et à la dose maximale de 2 mg/kg de poids corporel :
| Nombre de comprimés | |
Prednicure 5 mg pour chiens et pour chats | ||
Poids corporel (kg) | Dose minimale | Dose maximale |
≤ 2,5 kg | ¼ | 1 |
> 2,5 - 5 kg | ½ | 1-2 |
> 5 - 7,5 kg | ¾ | 2-3 |
> 7,5 - 10 kg | 1 | 3-4 |
> 10 - 12,5 kg | 1 ¼ | 4-5 |
> 12,5 - 15 kg | 1 ½ | 5-6 |
> 15 - 17,5 kg | 1 ¾ | 6-7 |
> 17,5 - 20 kg | 2 | 7-8 |
![]() = ¼ de comprimé
= ¼ de comprimé ![]() = ½ comprimé
= ½ comprimé ![]() = ¾ de comprimé
= ¾ de comprimé ![]() = 1 comprimé
= 1 comprimé
Les comprimés peuvent être divisés en 2 ou 4 parties égales afin d’assurer un dosage précis.
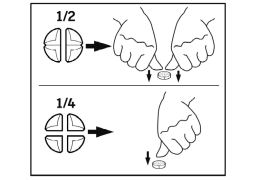
4.11 Temps d’attente
Sans objet.