RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
1. DÉNOMINATION DU MÉDICAMENT
Xtandi 40 mg, comprimé pelliculé
Xtandi 80 mg, comprimé pelliculé
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Xtandi 40 mg, comprimé pelliculé
Chaque comprimé pelliculé contient 40 mg d’enzalutamide.
Xtandi 80 mg, comprimé pelliculé
Chaque comprimé pelliculé contient 80 mg d’enzalutamide.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Comprimé pelliculé.
Xtandi 40 mg, comprimé pelliculé
Comprimé pelliculé jaune, rond, comportant la mention « E 40 » gravée.
Xtandi 80 mg, comprimé pelliculé
Comprimé pelliculé jaune, ovale, comportant la mention « E 80 » gravée.
4. INFORMATIONS CLINIQUES
4.1 Indications thérapeutiques
Xtandi est indiqué :
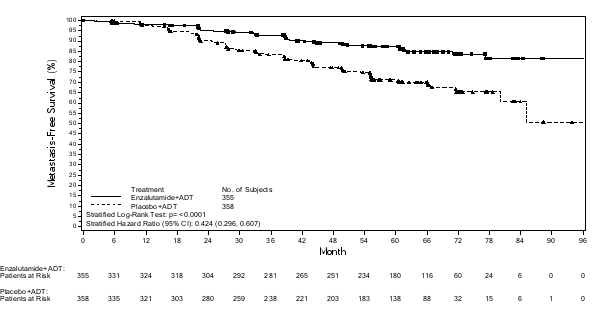
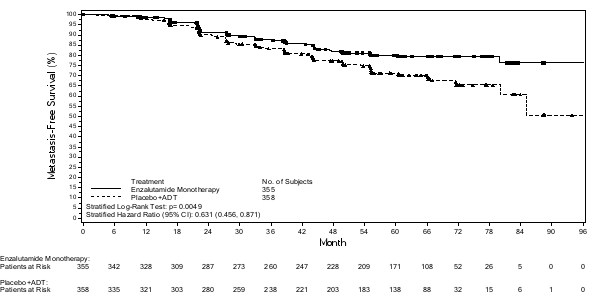
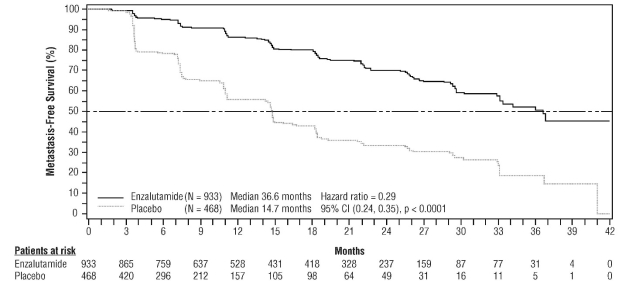
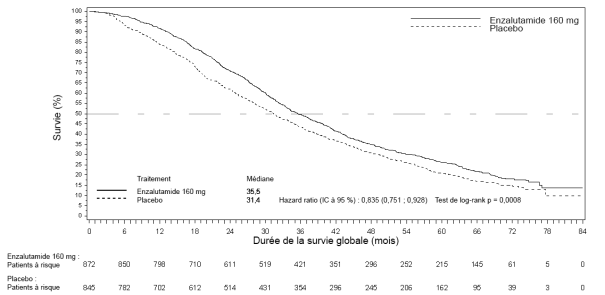
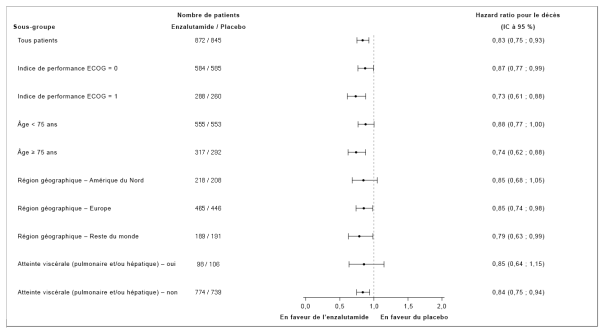
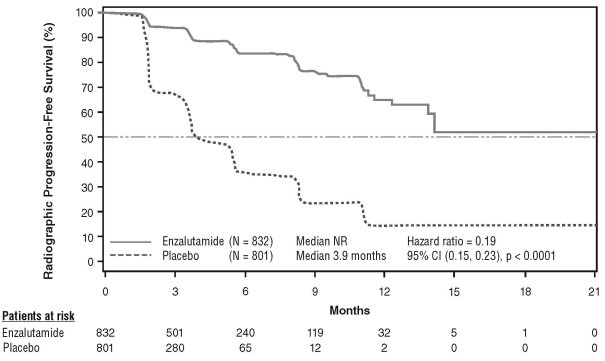
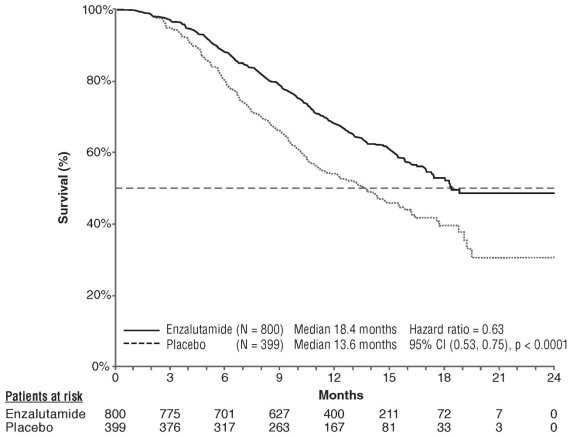
- en monothérapie ou en association avec un traitement par suppression androgénique dans le traitement du cancer de la prostate hormonosensible non métastatique (nmHSPC) en récidive biochimique (BCR) à haut risque chez les hommes adultes non éligibles à une radiothérapie de rattrapage (voir rubrique 5.1).
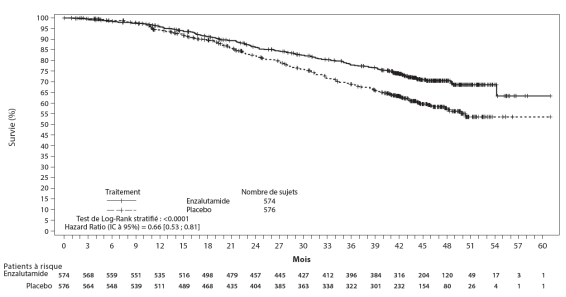
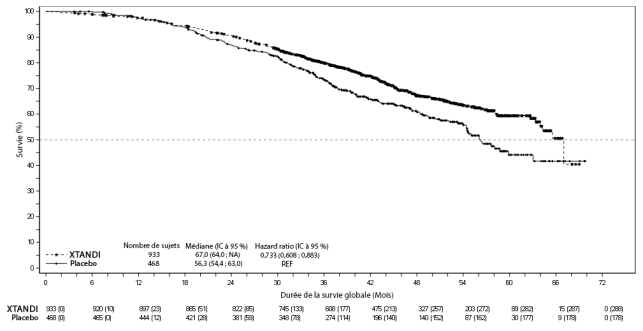
- en association avec un traitement par suppression androgénique dans le traitement du cancer de la prostate hormonosensible métastatique (mHSPC) chez les hommes adultes (voir rubrique 5.1).
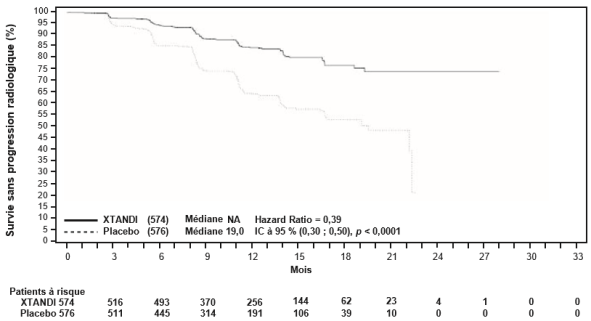
- dans le traitement du cancer de la prostate résistant à la castration (CPRC) non métastatique à haut risque chez les hommes adultes (voir rubrique 5.1).
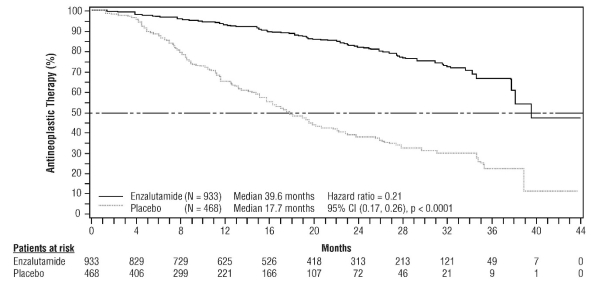
- dans le traitement du CPRC métastatique chez les hommes adultes asymptomatiques ou peu symptomatiques, après échec d’un traitement par suppression androgénique et pour lesquels la chimiothérapie n’est pas encore cliniquement indiquée (voir rubrique 5.1).
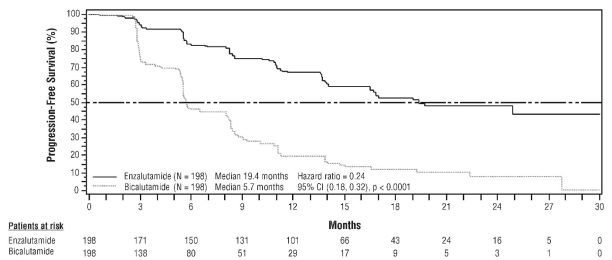
- dans le traitement du CPRC métastatique chez les hommes adultes dont la maladie a progressé pendant ou après une chimiothérapie à base de docétaxel.
4.2 Posologie et mode d’administration
Un traitement par enzalutamide doit être initié et supervisé par un médecin spécialiste expérimenté dans le traitement médical du cancer de la prostate.
Posologie
La dose recommandée est de 160 mg d’enzalutamide (quatre comprimés pelliculés de 40 mg ou deux comprimés pelliculés de 80 mg) en une seule prise quotidienne par voie orale.
La castration médicale par un analogue de l’hormone de libération de la lutéinostimuline (LHRH) doit être maintenue pendant la durée du traitement pour les patients atteints de CPRC ou de mHSPC n’ayant pas subi de castration chirurgicale.
Les patients atteints de nmHSPC en BCR à haut risque peuvent être traités par Xtandi avec ou sans analogue de la LHRH. Pour les patients recevant Xtandi avec ou sans analogue de la LHRH, le traitement peut être suspendu si le PSA est indétectable (< 0,2 ng/mL) après 36 semaines de traitement. Le traitement doit être réinstauré lorsque le PSA atteint ≥ 2,0 ng/mL chez les patients ayant subi une prostatectomie radicale ou ≥ 5,0 ng/mL chez les patients ayant subi une radiothérapie initiale. Si le taux de PSA est détectable (≥ 0,2 ng/mL) après 36 semaines de traitement, le traitement doit se poursuivre (voir rubrique 5.1).
Si le patient oublie de prendre la dose prescrite de Xtandi à l’heure habituelle, elle doit être administrée aussi près que possible de l’heure habituelle de prise. Si le patient oublie de prendre la dose prescrite de Xtandi pendant toute une journée, il convient de reprendre le traitement le lendemain à la dose quotidienne habituelle.
En cas de toxicité de grade supérieur ou égal à 3 ou d’effet indésirable intolérable, il convient de suspendre le traitement pendant une semaine ou jusqu’à ce que les symptômes reviennent à un grade inférieur ou égal à 2, puis de reprendre le traitement à la même dose ou à une dose réduite si nécessaire (120 mg ou 80 mg).
Utilisation concomitante avec des inhibiteurs puissants du CYP2C8
L’utilisation concomitante d’inhibiteurs puissants du CYP2C8 doit être évitée autant que possible. Si le patient doit recevoir un inhibiteur puissant du CYP2C8 de façon concomitante, la dose d’enzalutamide doit être réduite à 80 mg en une prise quotidienne. En cas d’arrêt de l’administration concomitante de l’inhibiteur puissant du CYP2C8, l’enzalutamide doit être repris à la dose utilisée avant l’instauration de l’inhibiteur puissant du CYP2C8 (voir rubrique 4.5).
Patients âgés
Aucune adaptation posologique n’est nécessaire chez les patients âgés (voir rubriques 5.1 et 5.2).
Insuffisance hépatique
Aucune adaptation posologique n’est nécessaire chez les patients présentant une insuffisance hépatique légère, modérée ou sévère (respectivement classes A, B et C de Child-Pugh). Un allongement de la demi-vie de l’enzalutamide a toutefois été observé chez les patients présentant une insuffisance hépatique sévère (voir rubriques 4.4 et 5.2).
Insuffisance rénale
Aucune adaptation posologique n’est nécessaire chez les patients présentant une insuffisance rénale légère à modérée (voir rubrique 5.2). La prudence est recommandée chez les patients présentant une insuffisance rénale sévère ou de stade terminal (voir rubrique 4.4).
Population pédiatrique
Il n’existe pas d’utilisation justifiée de l’enzalutamide dans la population pédiatrique dans l’indication du traitement du CPRC, du mHSPC ou du nmHSPC en BCR à haut risque chez les hommes adultes.
Mode d’administration
Xtandi est à utiliser par voie orale. Les comprimés pelliculés ne doivent pas être coupés, écrasés ou mâchés mais doivent être avalés entiers avec une quantité suffisante d’eau, et peuvent être pris avec ou sans nourriture.
4.3 Contre-indications
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
Femmes enceintes ou susceptibles de l’être (voir rubriques 4.6 et 6.6).
4.8 Effets indésirables
Résumé du profil de sécurité
Les effets indésirables les plus fréquents sont l’asthénie/fatigue, les bouffées de chaleur, l’hypertension, les fractures, et la chute. Les autres effets indésirables importants comprennent la cardiopathie ischémique et les convulsions.
Des cas de convulsions ont été rapportés chez 0,6 % des patients traités par enzalutamide, chez 0,1 % des patients sous placebo et chez 0,3 % des patients traités par bicalutamide.
De rares cas de Syndrome d’Encéphalopathie Postérieure Réversible ont été rapportés chez des patients traités par enzalutamide (voir rubrique 4.4).
Des cas de syndrome de Stevens-Johnson ont été rapportés avec un traitement par enzalutamide (voir rubrique 4.4).
Liste tabulée des effets indésirables
Les effets indésirables observés au cours des études cliniques sont listés ci-dessous par catégorie de fréquence. Les catégories sont définies comme suit : très fréquent (≥1/10) ; fréquent (≥1/100, <1/10) ; peu fréquent (≥1/1 000, <1/100) ; rare (≥1/10 000, <1/1 000) ; très rare (<1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles). Les effets indésirables sont classés par ordre de gravité décroissant dans chaque catégorie de fréquence.
Tableau 1 : Effets indésirables observés au cours des études cliniques comparatives et post- commercialisation
Classe de systèmes d’organes MedDRA | Effet indésirable et fréquence |
Affections hématologiques et du système lymphatique | Peu fréquent : leucopénie, neutropénie |
Affections du système immunitaire | Fréquence indéterminée * : œdème du visage, œdème de la langue, œdème labial, œdème pharyngé |
Troubles du métabolisme et de la nutrition | Fréquence indéterminée * : diminution de l’appétit |
Affections psychiatriques | Fréquent : anxiété |
Affections du système nerveux | Fréquent : céphalées, trouble de la mémoire, amnésie, troubles de l’attention, dysgueusie, syndrome des jambes sans repos, troubles cognitifs |
Affections cardiaques | Fréquent : cardiopathie ischémique† |
Affections vasculaires | Très fréquent : bouffées de chaleur, hypertension |
Affections gastro-intestinales | Fréquence indéterminée * : dysphagie∞, nausées, vomissements, diarrhée |
Affections hépatobiliaires | Peu fréquent : augmentation des enzymes hépatiques |
Affections de la peau et du tissu sous-cutané | Fréquent : sécheresse cutanée, prurit |
Affections musculo-squelettiques et systémiques | Très fréquent : fractures‡ |
Affections des organes de reproduction et du sein | Fréquent : gynécomastie, douleur du mamelon#, sensibilité mammaire# |
Troubles généraux et anomalies au site d’administration | Très fréquent : asthénie, fatigue |
Lésions, intoxications et complications liées aux procédures | Très fréquent : chute |
* Notifications spontanées issues de l’expérience post-commercialisation.
¥ Évalué par la requête standardisée du dictionnaire MedDRA (SMQ) étroite de « Convulsions », incluant convulsion, convulsion grand mal, crises partielles complexes, crises partielles et état de mal épileptique. Cela inclut les rares cas de convulsions avec des complications mortelles.
† Évalué par les SMQ étroites de « Infarctus du myocarde » et « Autres cardiopathies ischémiques » incluant les termes préférés suivants, observés chez au moins deux patients dans les études de phase III randomisées, contrôlées versus placebo : angor, maladie coronarienne, infarctus du myocarde, infarctus du myocarde aigu, syndrome coronarien aigu, angor instable, ischémie myocardique et artériosclérose coronaire.
‡ Inclut tous les termes préférés comportant le mot « fracture » osseuse.
# Effets indésirables pour l’enzalutamide en monothérapie.
∞ Des cas de dysphagie ont été rapportés, y compris des cas d’étouffement. Les deux évènements ont été principalement rapportés avec la forme capsule, ce qui pourrait être lié à une taille du produit plus importante (voir rubrique 4.4).
Description d’une sélection d’effets indésirables
Convulsions
Dans les études cliniques comparatives, 31 (0,6 %) des 5110 patients traités à la dose quotidienne de 160 mg d’enzalutamide ont présenté des convulsions, alors que quatre patients (0,1 %) parmi ceux ayant reçu le placebo et un patient (0,3 %) parmi ceux ayant reçu du bicalutamide ont présenté des convulsions. La dose semble être un facteur prédictif important du risque de convulsions, comme l’indiquent des données précliniques et les données obtenues lors d’une étude de recherche de dose. Dans les deux études cliniques comparatives, les patients présentant des antécédents de convulsions ou des facteurs de risque de convulsions ont été exclus.
Dans l’essai simple-bras 9785-CL-0403 (UPWARD) évaluant l’incidence des convulsions chez les patients présentant des facteurs de prédisposition aux convulsions (dont 1,6% avaient des antécédents de convulsions), 8 (2,2%) des 366 patients traités par enzalutamide ont présenté des convulsions. La durée moyenne de traitement était de 9,3 mois.
Le mécanisme par lequel l’enzalutamide pourrait abaisser le seuil épileptogène est inconnu mais pourrait être mis en rapport avec les données des études in vitro qui montrent que l’enzalutamide et son métabolite actif se lient au canal chlore du récepteur GABA et peuvent en inhiber l’activité.
Cardiopathie ischémique
Dans les études cliniques randomisées, contrôlées versus placebo, une cardiopathie ischémique est survenue chez 3,5 % des patients recevant l’enzalutamide plus un traitement par suppression androgénique versus 2 % des patients recevant le placebo plus un traitement par suppression androgénique. Quatorze patients (0,4 %) recevant l’enzalutamide plus un traitement par suppression androgénique et 3 patients (0,1 %) recevant le placebo plus un traitement par suppression androgénique ont présenté une cardiopathie ischémique ayant conduit au décès.
Dans l’étude EMBARK, une cardiopathie ischémique est survenue chez 5,4 % des patients recevant l’enzalutamide plus la leuproréline et 9 % des patients recevant l’enzalutamide en monothérapie. Aucun patient recevant l’enzalutamide plus la leuproréline et un patient (0,3 %) recevant l’enzalutamide en monothérapie ont présenté une cardiopathie ischémique ayant conduit au décès.
Gynécomastie
Dans l’étude EMBARK, une gynécomastie (tous grades confondus) a été observée chez 29 (8,2 %) des 353 patients recevant l’enzalutamide plus la leuproréline et 159 (44,9 %) des 354 patients recevant l’enzalutamide en monothérapie. Une gynécomastie de grade 3 ou supérieur n’a été observée chez aucun patient recevant l’enzalutamide plus la leuproréline et a été observée chez 3 patients (0,8 %) recevant l’enzalutamide en monothérapie.
Douleur du mamelon
Dans l’étude EMBARK, une douleur du mamelon (tous grades confondus) a été observée chez 11 (3,1 %) des 353 patients recevant l’enzalutamide plus la leuproréline et 54 (15,3 %) des 354 patients recevant l’enzalutamide en monothérapie. Une douleur du mamelon de grade 3 ou supérieur n’a été observée chez aucun patient recevant l’enzalutamide plus la leuproréline ou recevant l’enzalutamide en monothérapie.
Sensibilité mammaire
Dans l’étude EMBARK, une sensibilité mammaire (tous grades confondus) a été observée chez 5 (1,4 %) des 353 patients recevant l’enzalutamide plus la leuproréline et 51 (14,4 %) des 354 patients recevant l’enzalutamide en monothérapie. Une sensibilité mammaire de grade 3 ou supérieur n’a été observée chez aucun patient recevant l’enzalutamide plus la leuproréline ou recevant l’enzalutamide en monothérapie.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration.
Belgique
Agence fédérale des médicaments et des produits de santé
www.afmps.be
Division Vigilance:
Site internet: www.notifieruneffetindesirable.be
e-mail: adr@fagg-afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy ou Division de la pharmacie et des médicaments de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHÉ
Astellas Pharma Europe B.V.
Sylviusweg 62
2333 BE Leiden
Pays-Bas
8. NUMÉRO(S) D’AUTORISATION DE MISE SUR LE MARCHÉ
EU/1/13/846/002 (comprimé pelliculé 40 mg)
EU/1/13/846/003 (comprimé pelliculé 80 mg)
10. DATE DE MISE À JOUR DU TEXTE
05/06/2025
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments https://www.ema.europa.eu.
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 3899929 | XTANDI 40 MG COMP PELL 112 X 40MG | L02BB04 | - | € 2800,84 | Oui | - | - |