1. DÉNOMINATION DU MÉDICAMENT
Desorelle 20, 150/20 microgrammes comprimés pelliculés
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque comprimé pelliculé contient
150 microgrammes de désogestrel
20 microgrammes d’éthinylestradiol
Excipient à effet notoire : 64,3 mg de lactose (en tant que lactose monohydraté).
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Comprimé pelliculé
Comprimés pelliculés légèrement jaunes, ronds, biconvexes, d’un diamètre d’environ 6 mm, portant l’inscription P9 sur l’une des faces et RG sur l’autre.
4. DONNÉES CLINIQUES
4.1 Indications thérapeutiques
Contraception orale.
La décision de prescrire Desorelle 20 doit être prise en tenant compte des facteurs de risque de la patiente, notamment ses facteurs de risque de thrombo-embolie veineuse (TEV), ainsi que du risque de TEV associé à Desorelle 20 en comparaison aux autres CHC (Contraceptifs Hormonaux Combinés) (voir rubriques 4.3 et 4.4).
4.2 Posologie et mode d’administration
Posologie
Comment prendre Desorelle 20
Les comprimés doivent être pris dans l’ordre indiqué sur la plaquette, tous les jours environ à la même heure. Un comprimé doit être pris chaque jour pendant 21 jours consécutifs. Chaque plaquette suivante doit être commencée après un intervalle de 7 jours sans comprimés. Au cours de cette période survient habituellement une hémorragie de privation. Celle-ci débute habituellement 2 à 3 jours après le dernier comprimé et peut ne pas être terminée avant le début de la plaquette suivante.
Comment commencer à utiliser Desorelle 20
Pas de contraception hormonale antérieure (le mois précédent)
La prise du comprimé doit commencer le 1er jour du cycle menstruel normal (c-à-d. le premier jour des règles). Il est également possible de commencer la prise du premier comprimé entre le 2ème et le 5ème jour des règles ; il est cependant recommandé d’avoir recours en même temps à une méthode contraceptive de type barrière lors des 7 jours suivant la prise du premier comprimé au cours du premier cycle.
Relais d’une contraception hormonale combinée (contraceptif oral combiné (COC), anneau vaginal ou patch transdermique contraceptif combiné)
La femme doit débuter la prise de Desorelle 20 le jour suivant le dernier comprimé actif (le dernier comprimé contenant la substance active) du précédent COC, et au plus tard le jour suivant l’interruption habituelle sans prise de comprimés ou après la prise du dernier comprimé placebo (comprimé ne contenant aucune substance active) du précédent COC.
En cas d’utilisation antérieure d’un anneau vaginal ou d’un patch transdermique, il conviendra de commencer Desorelle 20 de préférence le jour du retrait. La femme peut aussi commencer à prendre Desorelle 20 le jour prévu pour l’application d’un nouvel anneau vaginal ou d’un nouveau dispositif transdermique, mais pas au-delà du jour en question.
Si la patiente a utilisé sa méthode contraceptive antérieure correctement et régulièrement et si la femme n’est pas enceinte, elle peut également substituer sa contraception hormonale antérieure à n’importe quel jour du cycle.
L’intervalle sans hormones de la méthode de contraception précédente ne peut jamais dépasser sa durée recommandée.
Il est possible que toutes les méthodes contraceptives (anneau vaginal, patch transdermique) ne soient pas commercialisées dans tous les pays de l’UE.
Relais d’un produit contenant uniquement un progestatif (pilule progestative, injection, implant ou système intra-utérin (SIU) libérant un progestatif).
Il est possible de passer d’une pilule progestative à Desorelle 20 à tout moment (le jour du retrait pour l’implant ou le SIU, ou le jour prévu pour l’injection suivante) mais dans tous les cas, il est recommandé d’utiliser une méthode contraceptive de barrière lors des 7 jours suivant la première prise.
Après un avortement au cours du premier trimestre de grossesse
La contraception peut être commencée immédiatement. Dans ce cas, aucune autre méthode contraceptive n’est nécessaire.
Après un accouchement ou un avortement au cours du second trimestre de grossesse
Pour l’allaitement, voir rubrique 4.6.
Il est recommandé de commencer la pilule 21 à 28 jours après un accouchement ou un avortement au cours du 2ème trimestre. Si la pilule est commencée plus tard, il est conseillé d’utiliser en plus une méthode contraceptive de type barrière pendant les 7 premiers jours de la contraception. Si des rapports sexuels ont déjà eu lieu, il convient d’exclure une éventuelle grossesse ou d’attendre les premières règles avant de commencer à prendre Desorelle 20.
Comprimés manqués
Si l’oubli du comprimé est constaté moins de 12 heures après l’heure habituelle de la prise, la protection contraceptive n’est pas diminuée. La patiente devra prendre le comprimé oublié dès qu’elle constate l’oubli et prendre les comprimés suivants comme d’habitude.
Si l’oubli du comprimé est constaté plus de 12 heures après l’heure habituelle de la prise, la protection contraceptive peut être diminuée. Les deux règles de base suivantes devront être prises en considération en cas d’oubli :
1. La prise continue de comprimés ne doit pas être interrompue pendant plus de 7 jours.
2. Une prise ininterrompue de comprimés pendant 7 jours est nécessaire pour atteindre une suppression suffisante de l’axe hypothalamo-hypophyso-gonadique.
Par conséquent, les conseils suivants devront être donnés pour la prise quotidienne :
Semaine 1
La femme devra prendre le comprimé oublié dès qu’elle constate l’oubli, même si cela implique la prise de deux comprimés en même temps. Elle continuera ensuite à prendre les comprimés à l’heure habituelle. Elle devra utiliser en même temps une méthode contraceptive de type barrière (par exemple un préservatif) pendant les 7 jours suivants. Si des rapports sexuels ont eu lieu au cours des 7 jours précédents, la possibilité d’une grossesse devra être envisagée. Plus le nombre de comprimés oubliés est important et plus l’oubli est proche de la période d’interruption de la prise, plus le risque de grossesse est grand.
Semaine 2
La femme devra prendre le comprimé oublié dès qu’elle constate l’oubli, même si cela implique la prise de deux comprimés en même temps. Elle continuera ensuite à prendre les comprimés à l’heure habituelle. Si les comprimés ont été pris correctement les 7 jours précédant l’oubli, aucune mesure contraceptive complémentaire n’est nécessaire. Cependant, si ce n’est pas le cas ou bien si plusieurs comprimés ont été oubliés, il conviendra de recommander à l’utilisatrice d’utiliser une autre méthode de contraception pendant 7 jours.
Semaine 3
Le risque d’une diminution de la protection contraceptive est imminent en raison de la proximité de la période de 7 jours d’interruption sans comprimés. Ce risque peut cependant être évité en adaptant la prise des comprimés. Il n’est donc pas nécessaire d’avoir recours à un moyen de contraception complémentaire si l’une des deux règles ci-dessous est respectée, tant que tous les comprimés ont été pris correctement les 7 jours précédant l’oubli. Si ce n’est pas le cas, il conviendra de recommander à l’utilisatrice de suivre l’une des deux solutions et d’utiliser en même temps un autre moyen de contraception au cours des 7 jours suivants.
1. La femme devra prendre le dernier comprimé oublié dès qu’elle constate l’oubli, même si cela implique la prise de deux comprimés en même temps. Elle continuera ensuite à prendre les comprimés à l’heure habituelle. Elle commencera la plaquette suivante immédiatement après avoir pris le dernier comprimé de la plaquette actuelle, c’est-à-dire qu’il n’y aura aucune pause entre les deux plaquettes. Il est très peu probable que la femme ait des règles avant la fin de la seconde plaquette mais elle peut avoir des « spottings » ou des métrorragies les jours de prise de comprimé.
2. La femme peut également arrêter de prendre les comprimés de la plaquette actuelle. Dans ce cas, elle gardera la période d’interruption de 7 jours, incluant les jours où le comprimé a été oublié, et commencera ensuite la nouvelle plaquette.
Si la femme a oublié des comprimés et que ses règles ne surviennent pas au cours de la première période normale sans comprimés, la possibilité d’une grossesse devra être envisagée.
Conseils en cas de troubles gastro-intestinaux
En cas de troubles gastro-intestinaux graves, un risque d’absorption insuffisante existe et des mesures contraceptives supplémentaires doivent être prises.
Si les vomissements surviennent dans les 3 à 4 heures suivant la prise du comprimé, se référer ci-dessus aux conseils en cas d’oubli.
Si la femme ne veut pas modifier son schéma habituel de prise, elle doit prendre le (les) comprimé(s) supplémentaire(s) nécessaire(s) dans une autre plaquette.
Comment retarder ou décaler une hémorragie de privation
Retarder les règles n’est pas une indication du produit. Cependant, si dans des cas exceptionnels, les règles doivent être retardées, la femme doit continuer avec une nouvelle plaquette de Desorelle 20 sans période d’interruption. Le report peut être étendu aussi longtemps que désiré jusqu’à la fin de la seconde plaquette. Au cours de ce report, des spottings ou métrorragies peuvent survenir. La prise régulière de Desorelle 20 reprend ensuite après l’interruption habituelle de 7 jours sans comprimés.
Pour décaler ses règles à un autre jour de la semaine que celui auquel la femme est habituée, il convient de lui conseiller de raccourcir la durée de la période d’interruption suivante d’autant de jours qu’elle le désire. Plus l’interruption sera courte, plus le risque sera grand qu’elle n’ait pas d’hémorragie de privation mais qu’elle présente des spottings ou des métrorragies au cours de la plaquette suivante (comme lors du report des règles).
Population pédiatrique
La sécurité et l’efficacité de Desorelle 20 chez l’adolescent de moins de 18 ans n’ont pas encore été établies. Aucune donnée n’est disponible.
Mode d’administration
Pour administration orale.
4.3 Contre-indications
Les contraceptifs hormonaux combinés (CHC) ne doivent pas être utilisés dans les situations suivantes.
Si l’une de ces affections survient pour la première fois au cours de l’utilisation d’un contraceptif oral, l’utilisation du contraceptif oral devra immédiatement être interrompue.
- Présence ou risque de thrombo-embolie veineuse (TEV)
- Thrombo-embolie veineuse – présence de TEV (patient traité par des anticoagulants) ou antécédents de TEV (p. ex. thrombose veineuse profonde [TVP] ou embolie pulmonaire [EP])
- Prédisposition connue, héréditaire ou acquise, à la thrombo-embolie veineuse, telle qu’une résistance à la protéine C activée (PCa) (y compris une mutation du facteur V de Leiden), un déficit en antithrombine III, un déficit en protéine C, un déficit en protéine S
- Intervention chirurgicale majeure avec immobilisation prolongée (voir rubrique 4.4)
- Risque élevé de thrombo-embolie veineuse dû à la présence de multiples facteurs de risque (voir rubrique 4.4)
- Présence ou risque de thrombo-embolie artérielle (TEA)
- Thrombo-embolie artérielle – présence ou antécédents de thrombo-embolie artérielle (p. ex. infarctus du myocarde [IM]) ou de prodromes (p. ex. angine de poitrine)
- Affection cérébrovasculaire – présence ou antécédents d’accident vasculaire cérébral (AVC) ou de prodromes (p. ex. accident ischémique transitoire [AIT])
- Prédisposition connue, héréditaire ou acquise, à la thrombo-embolie artérielle, telle qu’une hyperhomocystéinémie ou la présence d’anticorps anti-phospholipides (anticorps anti-cardiolipine, anticoagulant lupique).
- Antécédents de migraine avec signes neurologiques focaux (voir rubrique 4.4).
- Risque élevé de thrombo-embolie artérielle dû à la présence de multiples facteurs de risque (voir rubrique 4.4) ou d’un facteur de risque sévère tel que :
- diabète avec symptômes vasculaires
- hypertension artérielle sévère
- dyslipoprotéinémie sévère
- Présence ou antécédent d’affection hépatique sévère tant que les valeurs de la fonction hépatique ne sont pas normalisées.
- Présence ou antécédent de tumeurs hépatiques (bénignes ou malignes).
- Diagnostic ou suspicion de tumeurs malignes dépendantes des stéroïdes sexuelles (par exemple des organes génitaux ou des seins)
- Hyperplasie endométriale
- Saignements vaginaux sans diagnostic établi.
- Grossesse établie ou suspicion de grossesse
- Pancréatite ou antécédent de pancréatite si elle est associée à une hypertriglycéridémie sévère
- Hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique 6.1.
Desorelle 20 est contre-indiqué en administration concomitante avec les médicaments contenant l’association ombitasvir/paritaprévir/ritonavir, et le dasabuvir, ou médicaments contenant glécaprévir/pibrentasvir ou sofosbuvir/velpatasvir/voxilaprévir (voir rubrique 4.5).
4.8 Effets indésirables
Au cours de la première période de traitement, une grande partie des femmes (10 – 30 %) peuvent s’attendre à des effets indésirables comme tension mammaire, malaise et saignement. Cependant, ces effets indésirables sont généralement temporaires et disparaissent après 2 à 4 mois.
Description de certains effets indésirables particuliers
Une augmentation du risque d'événements thrombotique et thrombo-embolique artériel et veineux, incluant l’infarctus du myocarde, l’AVC, les accidents ischémiques transitoires, la thrombose veineuse et l’embolie pulmonaire, a été observée chez les femmes utilisant des CHC; ceci est abordé plus en détails en rubrique 4.4.
Plusieurs autres effets indésirables ont été rapportés chez des femmes utilisant des CHC. Ils sont décrits à la rubrique 4.4.
Comme avec tous les COC, des modifications des schémas des saignements vaginaux peuvent survenir, notamment au cours des premiers mois d’utilisation. Ces modifications peuvent inclure une modification de la fréquence des saignements (saignements absents, moins fréquents, plus fréquents ou continus), de leur intensité (réduite ou accrue) ou de leur durée.
Les effets secondaires ayant un lien possible avec le traitement qui ont été rapportés chez les utilisatrices de Desorelle 20 ou les utilisatrices de CHC en général sont énumérés dans le tableau ci-dessous3. Tous les effets indésirables sont classés par classe de systèmes d'organes et par fréquence: très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1000 à < 1/100), rare (≥1/10000 à < 1/1000) et fréquence indéterminée (fréquence ne peut être estimée sur la base des données disponibles).
Classe de systèmes d’organes | Très fréquents | Fréquents | Peu fréquents | Rares | Fréquence in déterminée |
Affections du système immunitaire |
|
|
| Réactions d’hypersensibilité | Exacerbation des symptômes de l'angiœdème héréditaire et acquis |
Troubles du métabolisme et de la nutrition |
|
| Rétention aqueuse |
|
|
Affections psychiatriques |
| Humeur dépressive | Diminution de la libido | Augmentation de la libido |
|
Affections du système nerveux |
| Céphalées | Migraine |
|
|
Affections oculaires |
|
|
| Intolérance aux lentilles de contact |
|
Troubles de l’oreille et du conduit auditif |
|
| Otosclérose |
|
|
Troubles vasculaires |
|
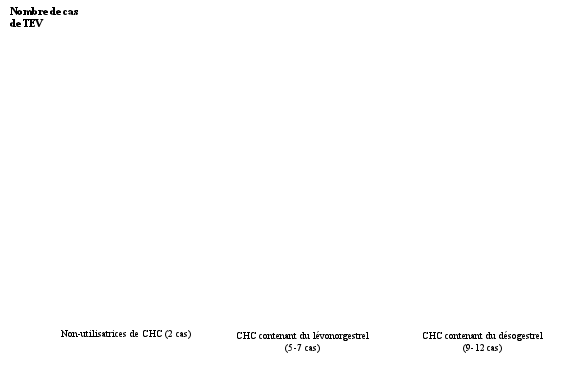
| Hypertension | Thromboembolie veineuse (TEV) , Thromboembolie artérielle (TEA) |
|
Affections gastro-intestinales |
| Nausées | Vomissements |
|
|
Affections de la peau et des tissus sous-cutanés |
| Acné | Éruption cutanée | Érythème noueux |
|
Affections des organes de reproduction et des seins | Saignements irréguliers | Douleur mammaire | Augmentation du volume des seins | Sécrétion vaginale |
|
Investigations |
| Prise de poids |
| Perte de poids |
|
3 Le terme MedDRA le plus approprié pour décrire un effet indésirable donné est mentionné. Les synonymes ou les affections apparentées ne sont pas indiquées, mais il conviendra également d’en tenir compte.
Les interactions
Des métrorragies et / ou un échec de la contraception peuvent être dus à des interactions d'autres médicaments (inducteurs d'enzymes) avec le contraceptif oral (voir rubrique 4.5).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via
Belgique
Agence fédérale des médicaments et des produits de santé
www.afmps.be
Division Vigilance:
Site internet: www.notifieruneffetindesirable.be
e-mail: adr@fagg-afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy ou Division de la pharmacie et des médicaments de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
Gedeon Richter Plc.
Gyömrői út 19-21
1103 Budapest
Hongrie
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHÉ
BE : BE339412
LU : 2009060001
● 0885628 : 13 x 21 comprimés pelliculés
● 0885631 : 1 x 21 comprimés pelliculés
● 0885645 : 3 x 21 comprimés pelliculés
● 0885659 : 6 x 21 comprimés pelliculés
10. DATE DE MISE À JOUR DU TEXTE
Date d’approbation: 01/2025
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 2612349 | DESORELLE 20 COMP 13 X 21 | G03AA09 | € 29,04 | - | Oui | - | - |
| 2612406 | DESORELLE 20 COMP 3 X 21 | G03AA09 | € 9,22 | - | Oui | € 0,22 | € 0,22 |
| 2612414 | DESORELLE 20 COMP 6 X 21 | G03AA09 | € 18,9 | - | Oui | € 0,9 | € 0,9 |