ANNEXE I
RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
1. DÉNOMINATION DU MÉDICAMENT
ONIVYDE pegylated liposomal 4.3 mg/ml, dispersion à diluer pour perfusion
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Un flacon de 10 ml de dispersion à diluer contient 43 mg de base anhydre libre d’irinotécan (sous forme de sel de sucrosofate dans une formulation liposomale pégylée).
Un ml de dispersion à diluer contient 4.3 mg de base anhydre libre d'irinotécan (sous forme de sel de sucrosofate dans une formulation liposomale pégylée).
Excipient à effet notoire
1 ml de dispersion à diluer contient 0,144 mmol (3,31 mg) de sodium.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Dispersion à diluer pour perfusion.
Dispersion liposomale isotonique opaque blanche à jaune clair.
Le pH de la dispersion à diluer est de 7,2 et l’osmolalité de 295 mosmol/kg.
4. INFORMATIONS CLINIQUES
4.1 Indications thérapeutiques
ONIVYDE pegylated liposomal est indiqué :
- en association avec l'oxaliplatine, le 5-fluorouracile (5-FU) et la leucovorine (LV) dans le traitement de première intention des patients adultes présentant un adénocarcinome du pancréas métastatique ;
- en association avec le 5-FU et la LV dans le traitement des adénocarcinomes du pancréas métastatique, chez les patients adultes en progression de la maladie après un traitement ayant comporté de la gemcitabine.
4.2 Posologie et mode d’administration
ONIVYDE pegylated liposomal ne doit être prescrit et administré aux patients que par des professionnels de santé expérimentés dans l’utilisation des anticancéreux.
ONIVYDE pegylated liposomal n’est pas équivalent aux formulations d’irinotécan non liposomal et ces formulations ne sont pas interchangeables.
Posologie
ONIVYDE pegylated liposomal ne doit pas être administré en monothérapie et doit être poursuivi jusqu'à la progression de la maladie ou jusqu’à ce qu'il ne soit plus toléré par le patient.
ONIVYDE pegylated liposomal en association avec l'oxaliplatine, le 5-fluorouracile et la leucovorine
ONIVYDE pegylated liposomal, l’oxaliplatine, la LV et le 5-FU doivent être administrés de façon séquentielle. La posologie recommandée d’ONIVYDE pegylated liposomal est de 50 mg/m2 en perfusion intraveineuse de 90 minutes, suivis de 60 mg/m2 d’oxaliplatine en perfusion intraveineuse de 120 minutes, suivis de 400 mg/m2 de LV en perfusion intraveineuse de 30 minutes, suivis de 2400 mg/m2 de 5-FU en perfusion intraveineuse de 46 heures. Ce schéma thérapeutique doit être administré toutes les 2 semaines.
L'oxaliplatine peut être arrêté s'il n'est pas bien toléré et le traitement par ONIVYDE pegylated liposomal + 5-FU/LV peut être poursuivi.
La dose initiale recommandée d'ONIVYDE pegylated liposomal chez les patients homozygotes pour l’allèle UGT1A1*28 est inchangée et reste de 50 mg/m2 administrés en perfusion intraveineuse de 90 minutes (voir rubriques 5.1 et 5.2).
ONIVYDE pegylated liposomal en association avec le 5-fluorouracile et la leucovorine :
ONIVYDE pegylated liposomal, la leucovorine et le 5‑fluorouracile doivent être administrés de façon séquentielle.
La posologie recommandée d’ONIVYDE pegylated liposomal est de 70 mg/m2 en perfusion intraveineuse de 90 minutes, suivis de 400 mg/m2 de LV en perfusion intraveineuse de 30 minutes, suivis de 2400 mg/m2 de 5-FU en perfusion intraveineuse de 46 heures, toutes les 2 semaines.
Il convient d’envisager de diminuer la dose initiale d’ONIVYDE pegylated liposomal à 50 mg/m2 chez les patients homozygotes pour l’allèle UGT1A1*28 (voir rubriques 4.8 et 5.1). Il convient d’envisager d’augmenter la dose d’ONIVYDE pegylated liposomal à 70 mg/m2 s’il est bien toléré lors des cycles suivants.
Prémédication
Il est recommandé d’administrer aux patients une prémédication aux doses standard de dexaméthasone (ou un corticostéroïde équivalent) en association avec un antagoniste des récepteurs 5-HT3 (ou autre antiémétique) au moins 30 minutes avant la perfusion d’ONIVYDE pegylated liposomal.
Ajustements posologiques
Toute modification de la dose doit être basée sur la toxicité précédente la moins favorable. La posologie de la leucovorine ne nécessite aucun ajustement.
ONIVYDE pegylated liposomal en association avec l'oxaliplatine, le 5-fluorouracile et la leucovorine
Tableau 1 : Modifications des doses recommandées pour l’association ONIVYDE pegylated liposomal + oxaliplatine/5-FU/LV
Grade des toxicités (valeur) selon les critères CTCAE du NCI† | Ajustements des doses d’ONIVYDE pegylated liposomal/ oxaliplatine/5‑FU | |
Toxicités hématologiques | ||
Neutropénie | Ne pas débuter de nouveau cycle de traitement avant d’atteindre un nombre absolu de neutrophiles ≥ 2000/mm3 (2 x 109/l) | |
Grade 3 ou Grade 4 (< 1000 cellules/mm3) ou neutropénie fébrile | Première apparition | Réduire la dose d’ONIVYDE pegylated liposomal à 80 % de la dose initiale |
Deuxième apparition | Réduire la dose d’ONIVYDE pegylated liposomal à 65 % de la dose initiale | |
Troisième apparition | Réduire la dose d’ONIVYDE pegylated liposomal à 50 % de la dose initiale | |
Quatrième apparition | Arrêter le traitement | |
Thrombopénie | Ne pas débuter de nouveau cycle de traitement avant d’atteindre une numération plaquettaire ≥ 100 000/mm3 (100 x 109/l). | |
Toxicités non hématologiques* | ||
Diarrhée | Ne pas débuter un nouveau cycle de traitement avant résolution de la diarrhée à un grade ≤ 1 (2 à 3 selles/jour de plus qu’avant l’administration du traitement) | |
Grade 2 | Ne pas débuter un nouveau cycle de traitement avant résolution de la diarrhée à un grade ≤ 1 (2 à 3 selles/jour de plus qu’avant l’administration du traitement) | |
Grade 3 ou 4 | Première apparition | Réduire la dose d’ONIVYDE pegylated liposomal à 80 % de la dose initiale |
Deuxième apparition | Réduire la dose d’ONIVYDE pegylated liposomal à 65 % de la dose initiale | |
Troisième apparition | Réduire la dose d’ONIVYDE pegylated liposomal à 50 % de la dose initiale | |
Quatrième apparition | Arrêter le traitement | |
Toutes les autres toxicités* | Première apparition | Réduire la dose d’ONIVYDE pegylated liposomal à 80 % de la dose initiale |
Deuxième apparition | Réduire la dose d’ONIVYDE pegylated liposomal à 65 % de la dose initiale | |
Troisième apparition | Réduire la dose d’ONIVYDE pegylated liposomal à 50 % de la dose initiale | |
Quatrième apparition | Arrêter le traitement | |
Pour les nausées et vomissements de grade ≥ 3 | Réduire la dose uniquement en cas de survenue malgré la prise d'un traitement anti-émétique optimal | |
Syndrome mains-pieds | Première apparition | Arrêter le traitement |
Toxicité neurocérébelleuse de tout grade ou toxicité cardiaque de grade ≥ 2 | Première apparition | Arrêter le traitement |
Réaction anaphylactique | Première apparition | Arrêter le traitement |
Pneumopathie interstitielle | Première apparition | Arrêter le traitement |
* Exceptéesl’asthénie et l'anorexie ; | ||
Les patients homozygotes pour l'allèle UGT1A1*28 doivent débuter ONIVYDE pegylated liposomal à la même dose et les mêmes recommandations en matière de réduction de la dose doivent s'appliquer.
ONIVYDE pegylated liposomal en association avec le 5-fluorouracile et la leucovorine :
Pour les patients qui débutent un traitement à la posologie de 50 mg/m2 d’ONIVYDE pegylated liposomal sans augmentation de la dose à 70 mg/m2, il est recommandé de procéder à une première réduction de la dose à 43 mg/m2 puis à une deuxième réduction à 35 mg/m2. Les patients nécessitant une réduction de dose supplémentaire doivent arrêter le traitement.
Chez les patients homozygotes pour l'allèle UGT1A1*28 et n'ayant pas présenté de toxicité liée au médicament au cours du premier cycle de traitement (dose réduite de 50 mg/m2), la dose d'ONIVYDE pegylated liposomal pourra être augmentée jusqu'à une dose totale de 70 mg/m2 au cours des cycles suivants, en fonction de la tolérance de chaque patient.
Tableau 2 : Modifications des doses recommandées pour ONIVYDE pegylated liposomal + 5‑FU/LV en cas de toxicité de grade 3 et 4 chez les patients non homozygotes pour l'allèle UGT1A1*28
Grades de toxicité (valeur) selon l’échelle NCI CTCAE1 | Ajustement d’ONIVYDE pegylated liposomal /5‑FU | |
Toxicités hématologiques
| ||
Neutropénie | Ne pas débuter de nouveau cycle de traitement avant d’atteindre un nombre absolu de neutrophiles de ≥ 1500 cellules/mm3 | |
Grade 3 ou 4 | Première apparition | Diminuer la dose d’ONIVYDE pegylated liposomal à 50 mg/m2 |
Deuxième apparition | Diminuer la dose d’ONIVYDE pegylated liposomal à 43 mg/m2 | |
Troisième apparition | Arrêter le traitement | |
Thrombopénie | Ne pas débuter de nouveau cycle de traitement avant d’atteindre une numération plaquettaire de ≥ 100 000 plaquettes/mm3 | |
Toxicités non hématologiques2
| ||
Diarrhée | Ne pas débuter de nouveau cycle de traitement avant résolution de la diarrhée à un grade ≤ 1 (2 à 3 selles/jour de plus qu’avant l’administration du traitement). | |
Grade 2 | Ne pas débuter de nouveau cycle de traitement avant résolution de la diarrhée à un grade ≤ 1 (2 à 3 selles/jour de plus qu'avant l'administration du traitement). | |
Grade 3 ou 4 | Première apparition | Diminuer la dose d’ONIVYDE pegylated liposomal à 50 mg/m2 |
Deuxième apparition | Diminuer la dose d’ONIVYDE pegylated liposomal à 43 mg/m2 | |
Troisième apparition | Arrêter le traitement | |
Nausées/vomissements | Ne pas débuter de nouveau cycle de traitement avant résolution des nausées ou vomissements à un grade ≤ 1 ou au niveau de référence. | |
Grade 3 ou 4 (malgré un traitement antiémétique) | Première apparition | Optimiser le traitement antiémétique |
Deuxième apparition | Optimiser le traitement antiémétique | |
Troisième apparition | Arrêter le traitement | |
Toxicités hépatiques, rénales, respiratoires ou autres2 | Ne pas débuter de nouveau cycle de traitement avant résolution des effets indésirables à un grade ≤ 1. | |
Première apparition | Diminuer la dose d’ONIVYDE pegylated liposomal à 50 mg/m2 | |
Deuxième apparition | Diminuer la dose d’ONIVYDE pegylated liposomal à 43 mg/m2 | |
Troisième apparition | Arrêter le traitement | |
Réaction anaphylactique | Première apparition | Arrêter le traitement |
Pneumopathie interstitielle | Première apparition | Arrêter le traitement |
1 NCI CTCAE = critères communs de terminologie des effets indésirables (CTCAE, Common Terminology Criteria for Adverse Events) établis par le National Cancer Institute, version en vigueur
2 Excluent l’asthénie et l’anorexie ; l’anorexie de grade 3 et l’asthénie ne nécessitent pas d’ajustement de dose.
Tableau 3 : Modifications des doses recommandées pour ONIVYDE pegylated liposomal + 5‑FU/LV en cas de toxicité de grade 3 et 4 chez les patients homozygotes pour l'allèle UGT1A1*28
Grades de toxicité (valeur) | Ajustement d’ONIVYDE pegylated liposomal /5‑FU | |
Effets indésirables2 | Ne pas débuter de nouveau cycle de traitement avant résolution de l'effet indésirable à un grade ≤ 1. | |
Première apparition | Diminuer la dose d'ONIVYDE pegylated liposomal à 43 mg/m2 | |
Deuxième apparition | Diminuer la dose d'ONIVYDE pegylated liposomal à 35 mg/m2 | |
Troisième apparition | Arrêter le traitement | |
Réaction anaphylactique | Première apparition | Arrêter le traitement |
Pneumopathie interstitielle | Première apparition | Arrêter le traitement |
1 NCI CTCAE = critères communs de terminologie des effets indésirables (CTCAE, Common Terminology Criteria for Adverse Events) établis par le National Cancer Institute, version en vigueur
2 Excluent l'asthénie et l'anorexie ; l'anorexie de grade 3 et l'asthénie ne nécessitent pas d'ajustement de dose.
3 Dans le cas d’une augmentation de dose d’ONIVYDE pegylated liposomal à 70mg/m2, si tolérée lors des cycles suivants, les recommandations de modifications de doses doivent suivre le tableau 2.
Populations particulières
Insuffisance hépatique
ONIVYDE pegylated liposomal n’a pas été étudié chez les patients présentant une insuffisance hépatique. L’utilisation d’ONIVYDE pegylated liposomal n’est pas recommandée chez les patients ayant un taux de bilirubine > 2,0 mg/dl, d’aspartate aminotransférase (AST) et d’alanine aminotransférase (ALT) > 2,5 fois la limite supérieure normale (LSN) ou > 5 fois cette limite en cas de métastases hépatiques (voir rubrique 4.4).
Insuffisance rénale
ONIVYDE pegylated liposomal n’a pas été étudié chez les patients présentant une insuffisance rénale. Aucune adaptation posologique n'est recommandée chez les patients présentant une insuffisance rénale légère à modérée (voir rubriques 4.4 et 5.2). L’utilisation d’ONIVYDE pegylated liposomal n’est pas recommandée chez les patients atteints d’une insuffisance rénale sévère (CLcr < 30 ml/min).
Patients âgés
Quarante-neuf pour cent (49,6 %) et quarante-et-un pour cent (41 %) des patients traités par ONIVYDE pegylated liposomal dans le cadre, respectivement, de l’étude NAPOLI-3 et de l’étude NAPOLI-1, étaient âgés de 65 ans ou plus. Aucun ajustement posologique n'est recommandé.
Population pédiatrique
La sécurité et l’efficacité d’ONIVYDE pegylated liposomal chez les enfants et adolescents âgés de 18 ans ou moins n’ont pas encore été établies. Aucune donnée n'est disponible.
Mode d’administration
ONIVYDE pegylated liposomal est destiné à une administration par voie intraveineuse. La dispersion doit être diluée avant d’être administrée par une perfusion intraveineuse de 90 minutes. Pour plus d’informations, voir rubrique 6.6.
Précautions à prendre avant la manipulation ou l’administration du médicament
ONIVYDE pegylated liposomal est un médicament cytotoxique. Il est recommandé de porter des gants, des lunettes et des vêtements de protection lors de la manipulation et de l’administration d’ONIVYDE pegylated liposomal. Les femmes enceintes ne doivent pas manipuler ONIVYDE pegylated liposomal.
4.3 Contre-indications
Antécédents d’hypersensibilité sévère à l’irinotécan ou à l’un des excipients mentionnés à la rubrique 6.1.
Allaitement (voir rubrique 4.6).
4.8 Effets indésirables
Résumé du profil de sécurité
ONIVYDE pegylated liposomal en association avec l'oxaliplatine, le 5-fluorouracile et la leucovorine (NALIRIFOX) :
Les effets indésirables suivants, liés à l'administration d'ONIVYDE pegylated liposomal, ont été signalés chez 370 patients traités en association avec l'oxaliplatine/5-FU/LV, n’ayant jamais reçu de chimiothérapie pour un adénocarcinome du pancréas métastatique.
Les effets indésirables les plus fréquents (incidence ≥ 20 %) sont : diarrhée, nausées, vomissements, appétit diminué, fatigue, asthénie, neutropénie, neutrophiles diminués et anémie. Les effets indésirables sévères les plus fréquents (≥ 5 % de grade 3 ou 4) sont : diarrhée, nausées, vomissements, appétit diminué, fatigue, asthénie, neutropénie, neutrophiles diminués, anémie et hypokaliémie. Les effets indésirables graves les plus fréquents (≥ 2 %) sont : diarrhée, nausées, vomissements et déshydratation.
Les effets indésirables observés avec ONIVYDE pegylated liposomal ont entraîné son arrêt définitif chez 9,5 % des patients ; l'effet indésirable le plus fréquent ayant entraîné l'arrêt du traitement est la neutropénie.
Des réductions de la dose d'ONIVYDE pegylated liposomal en raison d’événements indésirables (indépendamment de l'évaluation de la relation de causalité) ont été nécessaires chez 52,4 % des patients ; les événements indésirables les plus fréquents ayant nécessité une réduction de la dose (≥ 5 %) sont : diarrhée, nausées, neutropénie et neutrophiles diminués.
ONIVYDE pegylated liposomal a été interrompu en raison d'événements indésirables (indépendamment de l'évaluation de la relation decausalité) chez 1,9 % des patients ; les événements indésirables les plus fréquents ayant nécessité une interruption du traitement sont les réactions d'hypersensibilité et les réactions liées à la perfusion, qui sont survenues chez 0,5 % des patients.
ONIVYDE pegylated liposomal en association avec le 5-fluorouracile et la leucovorine :
Les effets indésirables suivants, liés à l’administration d’ONIVYDE pegylated liposomal, ont été rapportés chez 264 patients présentant un adénocarcinome du pancréas métastatique traités après une progression de la maladie faisant suite à un traitement à base de gemcitabine.
Les effets indésirables les plus fréquents (incidence ≥ 20 %) de l’association ONIVYDE pegylated liposomal + 5-FU/LV sont : diarrhée, nausées, vomissements, appétit diminué, neutropénie, fatigue, asthénie, anémie, stomatite et fièvre. Les effets indésirables graves les plus fréquents (≥ 2 %) du traitement par ONIVYDE pegylated liposomal sont : diarrhée, vomissements, neutropénie fébrile, nausées, fièvre, septicémie, déshydratation, choc septique, pneumonie, insuffisance rénale aiguë et thrombopénie.
Les taux d’effets indésirables conduisant à l’arrêt définitif du traitement étaient de 11 % pour le groupe ONIVYDE pegylated liposomal + 5‑FU/LV.
Les effets indésirables les plus fréquents conduisant à une interruption du traitement étaient l’infection et la diarrhée pour le groupe ONIVYDE pegylated liposomal + 5-FU/LV.
Tableau des effets indésirables
Les effets indésirables décrits dans cette rubrique sont issus des données des études et de l’expérience acquise après la commercialisation d’ONIVYDE pegylated liposomal.
Les effets indésirables pouvant survenir au cours du traitement par ONIVYDE pegylated liposomal sont résumés ci-dessous et classés par classe de système d’organes et fréquence (Tableau 4). Pour chaque classe de système d’organes et fréquence, les effets indésirables sont présentés par ordre décroissant de gravité. Les classes de fréquence utilisées pour les effets indésirables sont : très fréquent (≥ 1/10), fréquent (≥ 1/100, < 1/10), peu fréquent (≥ 1/1 000, < 1/100), rare (≥ 1/10 000, < 1/1 000)* et fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Tableau 4 : Effets indésirables rapportés chez les patients traités par ONIVYDE pegylated liposomal
Fréquence en fonction de la classe de systèmes d’organes* | En association avec l'oxaliplatine/5-FU/LV (dans le cadre de l'étude NAPOLI-3) | En association avec le 5-FU/LV |
Infections et infestations | ||
Fréquent | Septicémie, infection des voies urinaires, infection à Candida, rhinopharyngite | Choc septique, septicémie, pneumonie, neutropénie fébrile, gastroentérite, candidose orale |
Peu fréquent | Diverticulite, pneumonie, abcès anal, infection fébrile, gastroentérite, infection des muqueuses, mycose orale, infection à Clostridium difficile, conjonctivite, furoncle, herpès, laryngite, parodontite, rash pustuleux, sinusite, infection dentaire, infection mycotique vulvovaginale | Sepsis biliaire |
Tumeurs bénignes, malignes et non précisées (incl kystes et polypes) | ||
Peu fréquent | Œdème péritumoral |
|
Affections hématologiques et du système lymphatique | ||
Très fréquent | Anémie, neutropénie, thrombopénie | Neutropénie, leucopénie, anémie, thrombopénie |
Fréquent | Neutropénie fébrile, leucopénie, lymphopénie | Lymphopénie |
Peu fréquent | Pancytopénie, anémie hémolytique |
|
Affections du système immunitaire | ||
Peu fréquent | Hypersensibilité | Hypersensibilité |
Fréquence indéterminée |
| Réaction anaphylactique/anaphylactoïde, angioedème |
Troubles du métabolisme et de la nutrition | ||
Très fréquent | Hypokaliémie, appétit diminué | Hypokaliémie, hypomagnésémie, déshydratation, appétit diminué |
Fréquent | Déshydratation, hyponatrémie, hypophosphatémie, hypomagnésémie, hypoalbuminémie, hypocalcémie | Hypoglycémie, hyponatrémie, hypophosphatémie |
Peu fréquent | Déséquilibre électrolytique, hypercalcémie, mort cellulaire, hypochlorémie, goutte, hyperglycémie, hyperkaliémie, déficience en fer, malnutrition |
|
Affections psychiatriques | ||
Fréquent |
| Insomnie |
Peu fréquent | Insomnie, état confusionnel, dépression, névrose |
|
Affections du système nerveux | ||
Très fréquent | Neuropathie périphérique, dysgueusie, paresthésie | Sensation vertigineuse |
Fréquent | Tremblements, neurotoxicité, dysesthésie, syndrome cholinergique, céphalée, Sensation vertigineuse | Syndrome cholinergique, dysgueusie |
Peu fréquent | Convulsion, hémorragie cérébrale, ischémie cérébrale, accident ischémique cérébral, anosmie, agueusie, trouble de l'équilibre, hypersomnie, hypoesthésie, handicap intellectuel, léthargie, atteinte de la mémoire, prodromes de syncope, syncope, accident ischémique transitoire |
|
Affections oculaires | ||
Fréquent | Vision trouble |
|
Peu fréquent | Irritation oculaire, baisse de l'acuité visuelle |
|
Affections de l’oreille et du labyrinthe | ||
Peu fréquent | Vertiges |
|
Affections cardiaques | ||
Fréquent | Tachycardie | Hypotension |
Peu fréquent | Angine de poitrine, infarctus du myocarde aigu, palpitations |
|
Affections vasculaires | ||
Fréquent | Hypotension, événements thromboemboliques | Embolie pulmonaire, événements thomboemboliques |
Peu fréquent | Hypertension, froideur des extrémités, hématome, phlébite |
|
Affections respiratoires, thoraciques et médiastinales | ||
Fréquent | Embolie pulmonaire, hoquet, dyspnée, épistaxis | Dyspnée, dysphonie |
Peu fréquent | Douleur oropharyngée, toux, hyperoxie, inflammation nasale, atélectasie, dysphonie, pneumopathie inflammatoire | Hypoxie, Pneumopathie interstitielle diffuse (y compris pneumopathie inflammatoire) |
Affections gastro-intestinales | ||
Très fréquent | Diarrhée, nausées, vomissements, douleur/gêne abdominale, stomatite | Diarrhée, vomissements, nausées, douleur abdominale, stomatite |
Fréquent | Colite, entérocolite, constipation, bouche sèche, flatulence, distension abdominale, dyspepsie, reflux gastro-œsophagien, hémorroïdes, dysphagie | Colite, hémorroïdes |
Peu fréquent | Toxicité gastro-intestinale, occlusion duodénale, incontinence anale, ulcère aphteux, dysesthésie orale, douleur buccale, trouble de la langue, fissure anale, chéilite angulaire, dyschésie, paresthésie orale, caries dentaires, éructation, trouble gastrique, gastrite, trouble gingival, douleur gingivale, émission de selles sanglantes, hyperesthésie des dents, iléus paralytique, gonflement des lèvres, ulcération buccale, spasme œsophagien, parodontopathie, hémorragie rectale | Œsophagite, proctite |
Affections hépatobiliaires | ||
Fréquent | Hyperbilirubinémie | Hypoalbuminémie |
Peu fréquent | Cholangite, hépatite toxique, cholestase, cytolyse hépatique |
|
Affections de la peau et du tissu sous-cutané | ||
Très fréquent | Alopécie | Alopécie |
Fréquent | Sécheresse cutanée, érythrodysesthésie palmo-plantairea, éruption cutanée, hyperpigmentation cutanée | Prurit |
Peu fréquent | Prurit, hyperhidrose, dermite bulleuse, dermite exfoliative généralisée, érythème, toxicité pour les ongles, papule, pétéchies, psoriasis, peau sensible, exfoliation cutanée, lésion de la peau, télangiectasies, urticaire | Urticaire, rash, décoloration des ongles |
Fréquence indéterminée |
| Érythème |
Affections musculosquelettiques et du tissu conjonctif | ||
Fréquent | Faiblesse musculaire, myalgie, contractures musculaires |
|
Peu fréquent | Arthralgie, dorsalgie, douleur osseuse, extrêmités douloureuses, polyarthrite |
|
Affections du rein et des voies urinaires | ||
Fréquent | Insuffisance rénale aiguë | Insuffisance rénale aigüe |
Peu fréquent | Atteinte de la fonction rénale, insuffisance rénale, dysurie, protéinurie |
|
Affections des organes de reproduction et du sein | ||
Peu fréquent | Sécheresse vulvovaginale |
|
Troubles généraux et anomalies au site d’administration | ||
Très fréquent | Asthénie, inflammation muqueuse | Fièvre, œdème périphérique, inflammationmuqueuse, asthénie |
Fréquent | Fièvre, œdème, frissons | Réaction liée à la perfusion, œdème |
Peu fréquent | Malaise, détérioration générale de l'état de santé, inflammation, syndrome de défaillance multiviscérale, syndrome grippal, douleur thoracique non cardiaque, douleur axillaire, douleur thoracique, hypothermie, douleur, gonflement du visage, intolérance à la température, xérose |
|
Investigations | ||
Très fréquent | Poids diminué | Poids diminué |
Fréquent | Transaminases (ALT et AST) augmentées, phosphatase alcaline sanguine augmentée, gamma-glutamyltransférase augmentée, créatinine sanguine augmentée | Bilirubine augmentée, transaminases (ALT et AST) augmentées, INR augmenté |
Peu fréquent | INR augmenté, protides totaux diminués, clairance de la créatinine diminuée, intervalle QT prolongé à l'électrocardiogramme, monocytes augmentés, troponine I augmentée |
|
Lésions, intoxications et complications d’interventions | ||
Fréquent | Réaction liée à la perfusion. |
|
a Syndrome mains-pieds
* L'étude NAPOLI-1 ne permet pas d'estimer la fréquence des cas rares en raison de la petite taille de l’échantillon.
Description de certains effets indésirables
Myélosuppression
ONIVYDE pegylated liposomal en association avec l'oxaliplatine, le 5-fluorouracile et la leucovorine :
Une neutropénie fébrile d’issue fatale et une pancytopénie d’issue fatale sont survenues, chacune chez 0,3 % des patients du groupe recevant NALIRIFOX.
ONIVYDE pegylated liposomal en association avec le 5-fluorouracile et la leucovorine :
La myélosuppression (neutropénie/leucopénie, thrombopénie et anémie) était plus fréquente dans le groupe traité par ONIVYDE pegylated liposomal + 5-FU/LV que dans le groupe contrôle traité par 5‑FU/LV.
Neutropénie/leucopénie
ONIVYDE pegylated liposomal en association avec l'oxaliplatine, le 5-fluorouracile et la leucovorine :
Une leucopénie de grade 3 ou 4 est survenue chez 0,8 % des patients recevant NALIRIFOX.
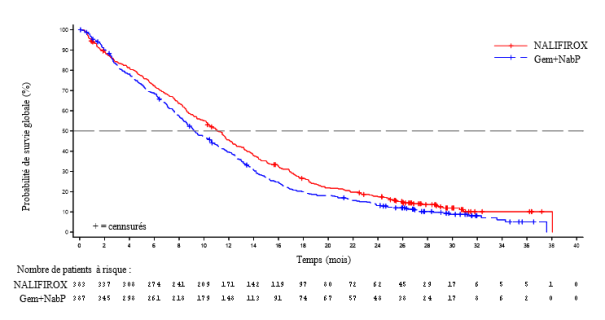
Dans l'étude NAPOLI-3, où le traitement par ONIVYDE pegylated liposomal plus oxaliplatine/5‑FU/LV (NALIRIFOX) a été comparé au traitement par gemcitabine plus nab-paclitaxel (Gem+NabP), les données sur la sécurité ont montré une incidence plus élevée de neutropénies dans le groupe recevant Gem+NabP. Une neutropénie de grade 3 ou 4, des neutrophiles diminués et une neutropénie fébrile sont survenues chez respectivement 14,1 %, 9,7 % et 1,9 % des patients recevant NALIRIFOX.
ONIVYDE pegylated liposomal en association avec le 5-fluorouracile et la leucovorine :
La neutropénie/leucopénie constituait la toxicité hématologique la plus importante. Une neutropénie de grade 3 ou plus est survenue plus fréquemment chez les patients traités par ONIVYDE pegylated liposomal + 5-FU/LV (27,4 %) que chez les patients traités par 5-FU/LV (1,5 %). Une fièvre neutropénique/septicémie est apparue plus fréquemment dans le groupe traité par ONIVYDE pegylated liposomal + 5-FU/LV (chez 4 patients [3,4 %]) que dans le groupe contrôle traité par 5-FU/LV (chez 1 patient [0,7 %]).
Le temps médian pour atteindre le nadir d’une neutropénie de grade ≥ 3 est de 23 jours (intervalle : 8-104) après la première administration du traitement par ONIVYDE pegylated liposomal.
Thrombopénie
ONIVYDE pegylated liposomal en association avec l'oxaliplatine, le 5-fluorouracile et la leucovorine :
Une thrombopénie de grade 3 ou 4 est survenue chez 0,5 % des patients recevant NALIRIFOX.
ONIVYDE pegylated liposomal en association avec le 5-fluorouracile et la leucovorine :
Une thrombopénie de grade 3 ou plus est survenue chez 2,6 % des patients traités par ONIVYDE pegylated liposomal + 5-FU/LV et chez 0 % des patients traités par 5-FU/LV.
Anémie
ONIVYDE pegylated liposomal en association avec l'oxaliplatine, le 5-fluorouracile et la leucovorine :
Une anémie de grade 3 ou 4 est survenue chez 7,3 % des patients recevant NALIRIFOX.
ONIVYDE pegylated liposomal en association avec le 5-fluorouracile et la leucovorine :
Une anémie de grade 3 ou plus est survenue chez 10,3 % des patients traités par ONIVYDE pegylated liposomal + 5‑FU/LV et chez 6,7 % des patients traités par 5‑FU/LV.
Insuffisance rénale aiguë
ONIVYDE pegylated liposomal en association avec l'oxaliplatine, le 5-fluorouracile et la leucovorine :
Dans l'étude NAPOLI-3, chez les patients recevant NALIRIFOX, une atteinte de la fonction rénale de grade 3 ou 4 est survenue chez 0,3 % des patients ; une insuffisance rénale de grade 1 à 4 est survenue chez 0,5 % des patients, parmi lesquels 0,3 % ont présenté une insuffisance rénale degrade 3 ou 4 ; une insuffisance rénale aiguë de grade 1 à 4 est survenue chez 1,1 % des patients, parmi lesquels 0,8 % ont présenté une insuffisance rénale aiguë de grade 3 ou 4. Chez les patients recevant NALIRIFOX,une créatinine sanguine augmentée de grade 1 à 4 est survenue chez 1,4 % des patients, parmi lesquels 0,3 % ont présenté une créatinine sanguine augmentée de grade 3 ou 4, et une clairance de la créatinine diminuée de grade 1 ou 2 est survenue chez 0,3 % des patients. Un cas (0,3 %) d'insuffisance rénale d’issue fatale a été observé dans le groupe recevant NALIRIFOX.
ONIVYDE pegylated liposomal en association avec le 5-fluorouracile et la leucovorine :
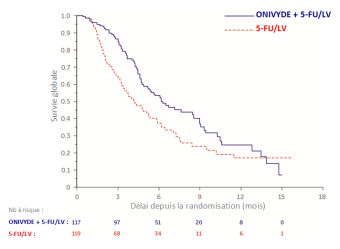
Dans l’étude NAPOLI-1, des atteintes de la fonction rénale et des insuffisances rénales aiguës ont été rapportées, généralement chez des patients ayant développé une hypovolémie du fait de nausées/vomissements et/ou de diarrhées. Une insuffisance rénale aiguë a été signalée chez 6 patients sur 117 (5,1 %) dans le groupe traité par ONIVYDE pegylated liposomal + 5 FU/LV.
Diarrhée et effets indésirables associés
ONIVYDE pegylated liposomal en association avec l'oxaliplatine, le 5-fluorouracile et la leucovorine :
Dans l'étude NAPOLI-3, les données sur la sécurité ont montré une incidence plus élevée de diarrhées dans le groupe recevant NALIRIFOX pour tous les grades et pour les grades 3 ou 4. Une diarrhée de grade 1 à 4 a été observée chez 64,3 % des patients et une diarrhée de grade 3 ou 4 a été observée chez 19,5 % des patients du groupe recevant NALIRIFOX. Des manifestations de type réaction cholinergique, telles que rhinite, rhinorrhée, hypersécrétion salivaire, bouffées congestives, bouffées de chaleur et une augmentation de la sécrétion lacrymale, ont été signalées chez des patients recevant NALIRIFOX.
ONIVYDE pegylated liposomal en association avec le 5-fluorouracile et la leucovorine :
Dans l’étude NAPOLI-1, des diarrhées de grade 3 ou 4 sont survenues chez 12,8 % des patients recevant ONIVYDE pegylated liposomal + 5-FU/LV. Pour les patients qui ont présenté des diarrhées tardives, le délai médian d’apparition de ces diarrhées était de 8 jours à compter de la dernière administration d’ONIVYDE pegylated liposomal. Une diarrhée précoce peut survenir dans les premières 24 heures après l'administration de la dose, mais l'épisode est généralement transitoire. Une diarrhée précoce peut également s’accompagner de symptômes cholinergiques tels que rhinite, hypersialorrhée, bouffées congestives, hypersudation, bradycardie, myosis et hyperpéristaltisme qui peut provoquer des crampes abdominales. Une diarrhée précoce est survenue chez 29,9 % des patients et des signes cholinergiques sont apparus chez 3,4 % des patients recevant l'association ONIVYDE pegylated liposomal + 5-FU/LV.
Réaction à la perfusion
ONIVYDE pegylated liposomal en association avec l'oxaliplatine, le 5-fluorouracile et la leucovorine :
Dans l'étude NAPOLI-3, une réaction liée à la perfusion est survenue chez 1,4 % des patients recevant NALIRIFOX. Toutes étaient d'intensité légère ou modérée (grade 1 ou 2).
ONIVYDE pegylated liposomal en association avec le 5-fluorouracile et la leucovorine :
Dans l’étude NAPOLI-1, une réaction aiguë à la perfusion a été signalée chez 6,8 % des patients dans le groupe traité par ONIVYDE pegylated liposomal + 5-FU/LV.
Autres populations particulières
Patients âgés
Dans l'ensemble, aucune différence clinique majeure en termes de sécurité n'a été rapportée entre les patients âgés de 65 ans ou plus et les patients âgés de moins de 65 ans.
ONIVYDE pegylated liposomal en association avec l'oxaliplatine, le 5-fluorouracile et la leucovorine :
Dans l'étude NAPOLI-3, l'âge médian était de 65 ans (intervalle : 20 à 85 ans), 50,1 % des patients avaient au moins 65 ans et 6,9 % des patients étaient âgés de 75 ans ou plus. Les données sur la sécurité par tranche d'âge étaient conformes aux données de l’ensemble de la population du bras NALIRIFOX.
ONIVYDE pegylated liposomal en association avec le 5-fluorouracile et la leucovorine :
Dans l’étude NAPOLI-1, un taux plus important d'interruption a été observé chez les patients âgés de ≥ 65 ans par rapport à ceux âgés de < 65 ans traités par ONIVYDE pegylated liposomal + 5-FU/LV (respectivement 14,8 % vs. 7,9 %) et dans certains cas, les effets indésirables n'ont pu être résolus. Les effets indésirables graves et de grade 3 ou plus dus au traitement étaient plus fréquents chez les patients de moins de 65 ans (84,1 % et 50,8 %) que chez les patients de 65 ans ou plus (68,5 % et 44,4 %). Inversement, les patients de plus de 75 ans (n = 12) ont plus fréquemment présenté des effets indésirables graves, des retards de dose, des diminutions de doses et des interruptions de traitement que les patients de 75 ans ou moins (n = 105) lorsqu'ils étaient traités par ONIVYDE pegylated liposomal + 5-FU/LV lors de l'étude sur les adénocarcinomes pancréatiques.
Population asiatique
Dans l’étude NAPOLI-1, par comparaison à la population caucasienne, il a été observé chez les patients asiatiques une incidence plus faible de la diarrhée (14 patients caucasiens [19,2 %] sur 73 présentaient une diarrhée ≥ grade 3, et 1 patient asiatique [3,3 %] sur 33 présentait une diarrhée ≥ grade 3), mais l'incidence et la sévérité de la neutropénie étaient plus élevées. Chez les patients recevant l’association ONIVYDE pegylated liposomal + 5-FU/LV, l’incidence d’une neutropénie ≥ grade 3 était supérieure chez les patients asiatiques (18 sur 33 [55 %]) comparé aux patients caucasiens (13 sur 73 [18 %]). Une fièvre neutropénique/sepsis neutropénique a été signalé(e) chez 6 % des patients asiatiques contre 1 % des patients caucasiens. Cela est cohérent avec l’analyse pharmacocinétique réalisée sur cette population et qui a montré une exposition plus faible à l’irinotécan et une exposition plus élevée à son métabolite actif, le SN-38, chez les patients asiatiques que chez les patients caucasiens.
Patients présentant une insuffisance hépatique
Dans des études cliniques sur l'irinotécan non liposomal administré selon un schéma hebdomadaire, les patients ayant, préalablement à la mise en œuvre du traitement, des taux de bilirubine totale sérique modestement élevés (1,0 à 2,0 mg/dl) avaient beaucoup plus de risques de développer une neutropénie de grade 3 ou 4 au cours du premier cycle que les patients ayant des taux de bilirubine inférieurs à 1,0 mg/dl.
Patients avec allèle UGT1A1
Des sujets homozygotes 7/7 pour l’allèle UGT1A1*28 présentent un risque plus élevé de développer une neutropénie lors d’un traitement par l’irinotécan non liposomal. Dans l’étude NAPOLI-1, la fréquence d’une neutropénie ≥ grade 3 chez ces patients (2 sur 7 [28,6 %]) était similaire à la fréquence observée chez des patients non homozygotes pour l’allèle UGT1A1*28 ayant reçu une dose initiale de 70 mg/m2 d’ONIVYDE pegylated liposomal (30 sur 110 [27,3 %]) (voir rubrique 5.1). Cette observation n'a pas été évaluée dans le cadre de l'étude NAPOLI-3.
Patients en insuffisance pondérale (indice de masse corporelle < 18,5 kg/m2)
Dans l'étude NAPOLI-1, 5 des 8 patients en insuffisance pondérale ont présenté des effets indésirables de grade 3 ou 4, principalement une myélosuppression, et pour 7 d’entre eux, il a été nécessaire de modifier l’administration, comme retarder l’administration, diminuer la dose ou arrêter le traitement (voir rubrique 4.4). Cette observation n'a pas été évaluée dans le cadre de l'étude NAPOLI-3.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration :
Belgique
Agence fédérale des médicaments et des produits de santé
www.afmps.be
Division Vigilance
Site internet : www.notifieruneffetindesirable.be
E-mail : adr@fagg-afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy
ou Division de la pharmacie et des médicaments
de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHÉ
Les Laboratoires Servier
50, rue Carnot
92284 Suresnes Cedex
France
8. NUMÉRO(S) D’AUTORISATION DE MISE SUR LE MARCHÉ
EU/1/16/1130/001
10. DATE DE MISE À JOUR DU TEXTE
09/2024
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments https://www.ema.europa.eu.
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 3945714 | ONIVYDE 4,3MG/ML FL 1 X 10ML | L01CE02 | - | € 793,69 | Oui | - | - |