1. DÉNOMINATION DU MÉDICAMENT
Oncaspar 750 U/ml, poudre pour solution injectable/pour perfusion.
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque flacon contient 3 750 unités (U)** de pégaspargase*.
Après reconstitution, 1 ml de solution contient 750 U de pégaspargase (750 U/ml).
* La substance active est un conjugué covalent de L-asparaginase dérivée d’Escherichia coli et de monométhoxypolyéthylène glycol.
** Une unité se définit comme la quantité d’enzymes nécessaire pour libérer 1 µmol d’ammoniaque par minute à un pH de 7,3 et à 37 °C.
L’activité de ce médicament ne doit pas être comparée à celle d’une autre protéine pégylée ou non pégylée de la même classe thérapeutique. Pour plus d’informations, voir rubrique 5.1.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Poudre pour solution injectable/pour perfusion.
Poudre blanche à blanc cassé.
4. DONNÉES CLINIQUES
4.1 Indications thérapeutiques
Oncaspar est utilisé en association à d’autres agents antinéoplasiques pour le traitement de la leucémie lymphoblastique aiguë (LLA) chez les patients pédiatriques de la naissance jusqu’à 18 ans et chez les patients adultes.
4.2 Posologie et mode d’administration
Oncaspar doit être prescrit et administré par des médecins et/ou des professionnels de santé expérimentés dans l’utilisation des médicaments antinéoplasiques. Il ne doit être administré qu’en milieu hospitalier où du matériel de réanimation adapté est disponible. Les patients doivent être étroitement surveillés afin de détecter d’éventuels effets indésirables pendant la période d’administration (voir rubrique 4.4).
Posologie
Oncaspar est généralement administré dans des protocoles de chimiothérapie, en association avec d’autres agents antinéoplasiques (voir aussi rubrique 4.5).
Prémédication recommandée
Prémédiquer les patients avec du paracétamol, un inhibiteur des récepteurs H-1 (ex : la diphénhydramine), et un inhibiteur des récepteurs H-2 (ex : la famotidine) 30 à 60 minutes avant l’administration d’Oncaspar afin de réduire le risque et la sévérité des réactions d’hypersensibilité et des réactions liées à la perfusion (voir la rubrique 4.4).
Population pédiatrique et adultes ≤ 21 ans
La dose recommandée chez les patients âgés de 21 ans et moins et dont la surface corporelle est supérieure ou égale à 0,6 m2 est de 2 500 U de pégaspargase (équivalant à 3,3 ml d’Oncaspar)/m² de surface corporelle tous les 14 jours.
Chez les enfants dont la surface corporelle est inférieure à 0,6 m², la dose recommandée est de 82,5 U de pégaspargase (équivalant à 0,1 ml d’Oncaspar)/kg de poids corporel tous les 14 jours.
Adultes > 21 ans
Sauf indication contraire, la posologie recommandée chez les adultes âgés de plus de 21 ans est de 2 000 U de pégaspargase (équivalant à 2,67 ml d’Oncaspar)/m2 de surface corporelle tous les 14 jours.
Le traitement peut être surveillé en se basant sur l’activité sérique minimale de l’asparaginase, mesurée avant la prochaine administration de pégaspargase. Si les valeurs de l’activité de l’asparaginase n’atteignent pas les taux cibles, le remplacement par une autre préparation à base d’asparaginase peut être envisagé (voir rubrique 4.4).
Populations particulières
Insuffisants rénaux
Étant donné que la pégaspargase est une protéine de haut poids moléculaire, elle n’est pas excrétée par les reins ; aucun ajustement posologique n’est nécessaire chez les patients ayant une insuffisance rénale.
Insuffisants hépatiques
Aucun ajustement posologique n’est nécessaire chez les patients ayant une insuffisance hépatique.
Sujets âgés
Les données disponibles pour les patients âgés de plus de 65 ans sont limitées.
Mode d’administration
Oncaspar peut être administré par injection intramusculaire (IM) ou par perfusion intraveineuse (IV).
Pour les plus petits volumes, il est préférable d’administrer par voie intramusculaire. Lorsqu’Oncaspar est administré par injection intramusculaire, le volume injecté à un même endroit ne doit pas dépasser 2 ml chez l’enfant et l’adolescent, et 3 ml chez l’adulte. En cas d’administration de volumes plus importants, la dose doit être divisée et administrée en plusieurs sites d’injection.
La perfusion intraveineuse d’Oncaspar est généralement administrée sur une période de 1 à 2 heures, dans 100 ml de solution injectable de chlorure de sodium à 9 mg/ml (0,9 %) ou dans une solution de glucose à 5 %.
La solution diluée peut être administrée avec une perfusion déjà en cours de chlorure de sodium à 9 mg/ml ou de glucose à 5 %. Ne pas perfuser d’autres médicaments par la même ligne intraveineuse en même temps qu’Oncaspar.
Pour les instructions concernant la reconstitution et la dilution de ce médicament avant administration, voir la rubrique 6.6.
4.3 Contre-indications
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
Déficience hépatique sévère (bilirubine > 3 fois la limite supérieure de la normale [LSN] ; transaminases > 10 x LSN).
Antécédents de thrombose grave lors d’un précédent traitement par L-asparaginase.
Antécédents de pancréatite, y compris de pancréatite liée à un traitement antérieur par L‑asparaginase (voir rubrique 4.4).
Antécédents d’événements hémorragiques graves lors d’un précédent traitement par L-asparaginase (voir rubrique 4.4).
4.8 Effets indésirables
Résumé du profil de sécurité
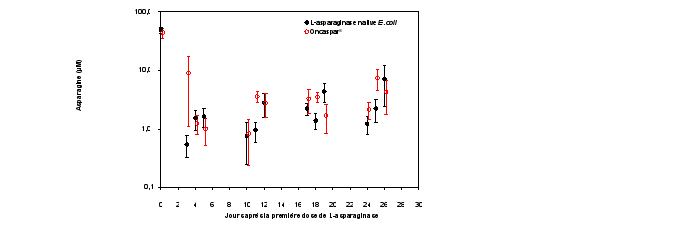
Les effets indésirables décrits dans cette rubrique sont issus des données des études cliniques et de pharmacovigilance menés sur Oncaspar chez des patients atteints de LLA. Le profil de sécurité est basé sur les études multicentriques, randomisées, contrôlées, prospectives, ouvertes utilisant Oncaspar à la dose de 2 500 U/m2 administrée par voie intraveineuse comme traitement comparatif (études DFCI 11‑001 et AALL07P4). En outre, le profil de sécurité inclut des donnés d’autres études menées sur Oncaspar comme l’étude comparant la pharmacocinétique des formulations liquide et lyophilisée de la pegaspargase (CL2-95014-002), son étude d’extension (CL2-95014-003) et des études utilisant la voie d’administration intramusculaire (études CCG‑1962 et CCG‑1991) ont également été prises en compte pour déterminer le profil de sécurité (voir rubrique 5.1 pour CCG-1962 et CCG-1991).
Les effets indésirables les plus fréquemment observés avec Oncaspar (dans au moins 2 études à une fréquence > 10 %) incluaient : alanine aminotransférase augmentée, aspartate aminotransférase augmentée, bilirubine sanguine augmentée, temps de céphaline activée allongé, hypertriglycéridémie, hyperglycémie et neutropénie fébrile.
Les effets indésirables sévères les plus fréquemment observés avec Oncaspar (grade 3 ou 4) dans les études DFCI 11‑001 et AALL07P4, à une fréquence > 5 % incluaient : alanine aminotransférase augmentée, aspartate aminotransférase augmentée, bilirubine sanguine augmentée, neutropénie fébrile, hyperglycémie, lipase augmentée et pancréatite.
Liste tabulée des effets indésirables
Les effets indésirables et leur fréquence sont présentés dans le Tableau 1. Les fréquences sont définies par la convention suivante : très fréquent (≥1/10), fréquent (≥1/100, <1/10), peu fréquent (≥1/1 000, <1/100), rare (≥1/10 000, <1/1 000), très rare (<1/10 000), et fréquence indéterminée (ne peut être estimée sur la base des données disponibles). Au sein de chaque groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
Tableau 1 : Effets indésirables rapportés lors du traitement par Oncaspar
Classe de systèmes d’organes MedDRA | Effets indésirables |
Infections et infestations | Fréquent : infections, septicémie |
Affections hématologiques et du système lymphatique | Très fréquent : neutropénie fébrile |
Fréquent : anémie, coagulopathie | |
Fréquence indéterminée : insuffisance de la moelle osseuse | |
Affections du système immunitaire | Très fréquent : hypersensibilité, urticaire, réaction anaphylactique |
Fréquence indéterminée : choc anaphylactique | |
Troubles du métabolisme et de la nutrition | Très fréquent : appétit diminué, hyperglycémie |
Fréquent : hyperlipidémie, hypercholestérolémie | |
Fréquence indéterminée : acidocétose diabétique, hypoglycémie | |
Affections psychiatriques | Fréquence indéterminée : état confusionnel |
Affections du système nerveux | Fréquent : convulsion, neuropathie motrice périphérique, syncope |
Rare : syndrome de leucoencéphalopathie postérieure réversible | |
Fréquence indéterminée : somnolence, tremblement* | |
Affections vasculaires | Très fréquent : embolie** |
Fréquent : thrombose*** | |
Fréquence indéterminée : accident cérébrovasculaire, hémorragie, thrombose du sinus sagittal supérieur | |
Affections respiratoires, thoraciques et médiastinales | Fréquent : hypoxie |
Affections gastro-intestinales | Très fréquent : pancréatite, diarrhée, douleur abdominale, nausées |
Fréquent : vomissement, stomatite, ascite | |
Rare : pancréatite nécrosante, pancréatite hémorragique | |
Fréquence indéterminée : pseudokyste pancréatique, parotidite* | |
Affections de la peau et du tissu sous-cutané | Très fréquent : rash |
Fréquence indéterminée : nécrolyse épidermique toxique* | |
Affections hépatobiliaires | Fréquent : hépatotoxicité, stéatose hépatique |
Rare : nécrose hépatique, ictère, cholestase, insuffisance hépatique | |
Fréquence indéterminée : maladie veino-occlusive | |
Affections musculo-squelettiques et systémiques | Fréquent : extrémités douloureuses |
Fréquence indéterminée : ostéonécrose (voir sections 4.4 et 4.5) | |
Affections du rein et des voies urinaires | Fréquence indéterminée : insuffisance rénale aiguë* |
Troubles généraux et anomalies au site d’administration | Fréquence indéterminée : pyrexie |
Investigations | Très fréquent : poids diminué, hypoalbuminémie, alanine aminotransférase augmentée, aspartate aminotransférase augmentée, hypertriglycéridémie, fibrinogène sanguin diminué, lipase augmentée, amylase augmentée, temps de céphaline activée allongé, bilirubine sanguine augmentée, antithrombine III diminuée****, neutrophiles diminués**** |
Fréquent : TP (temps de prothrombine) allongé, INR augmenté, hypokaliémie, cholestérol sanguin augmenté, hypofibrinogénémie, gamma-glutamyltransférase augmentée | |
Fréquence indéterminée : urée sanguine augmentée, anticorps anti-pégaspargase, numération plaquettaire diminuée, hyperammoniémie | |
*Effets indésirables observés avec d’autres médicaments à base d’asparaginase de la même classe | |
Description de certains effets indésirables
Les effets indésirables suivants ont été observés lors d’un traitement concomitant par asparaginase. Bien qu’ils n’aient pas été associés spécifiquement à l’utilisation de la pégaspargase, ils peuvent se produire avec Oncaspar :
Affections hématologiques et du système lymphatique
Oncaspar peut provoquer une myélosuppression légère à modérée et les trois lignées cellulaires sanguines peuvent être affectées.
Environ la moitié des hémorragies et thromboses graves affectent les vaisseaux cérébraux et peuvent induire par exemple un accident vasculaire cérébral, des convulsions, des céphalées ou une perte de conscience.
Affections du système nerveux
Oncaspar peut provoquer des dysfonctionnements du système nerveux central qui se manifestent par des convulsions, et moins souvent par un état confusionnel et de la somnolence (état de conscience légèrement altéré).
Dans de rares cas, un syndrome de leucoencéphalopathie postérieure réversible (SLPR) peut se produire.
De très rares cas de légers tremblements des doigts ont été rapportés.
Affections gastro-intestinales
Environ la moitié des patients présentent des réactions gastro-intestinales légères à modérées telles qu’une perte d’appétit, des nausées, des vomissements, des crampes abdominales, de la diarrhée et une perte de poids.
Les pancréatites aiguës sont fréquentes. Des cas isolés de formation de pseudo-kystes ont été rapportés (jusqu’à 4 mois après la dernière administration).
Les pancréatites hémorragiques ou nécrosantes sont rares. Un cas de pancréatite avec parotidite aiguë simultanée a été décrit avec le traitement par L-asparaginase. Un seul cas de pancréatite nécrosante ou hémorragique d’issue fatale a été signalé.
L’amylase sérique peut augmenter pendant le traitement par Oncaspar et également après son arrêt.
Affections du rein et des voies urinaires
Une insuffisance rénale aiguë peut se développer dans de rares cas pendant un traitement avec des produits contenant de la L-asparaginase.
Affections de la peau et du tissu sous-cutané
Des réactions allergiques cutanées peuvent se manifester. Un cas de nécrolyse épidermique toxique (syndrome de Lyell) associé à la L-asparaginase a été rapporté.
Affections endocriniennes
Des altérations de la fonction endocrine du pancréas sont fréquemment observées et se manifestent principalement sous la forme d’un métabolisme anormal du glucose. Des cas d’acidocétose diabétique et d’hyperglycémie hyperosmolaire, répondant généralement bien à l’administration d’insuline, ont été rapportés.
Troubles du métabolisme et de la nutrition
Une altération des taux lipidiques sériques a été observée ; des modifications des valeurs lipidiques sériques, dans la plupart des cas sans symptômes cliniques, sont très fréquentes.
Une augmentation de l’urée sérique s’observe régulièrement ; elle n’est pas liée à la dose et est presque toujours le signe avant-coureur d’un déséquilibre du métabolisme rénal.
Troubles généraux et anomalies au site d’administration
De la fièvre peut apparaître après l’injection, mais elle disparaît généralement spontanément.
Affections du système immunitaire
L’apparition d’anticorps spécifiques dirigés contre la pégaspargase a été détectée. Dans de rares cas, ils ont été associés à des réactions d’hypersensibilité. L’apparition d’anticorps neutralisants entraînant une baisse de l’efficacité clinique a également été signalée.
Des réaction d’hypersensibilité à Oncaspar, incluant une réaction anaphylactique potentiellement mortelle, un angioedème, un gonflement des lèvres, un gonflement oculaire, un erythème, une diminution de la pression artérielle, un bronchospasme, une dyspnée, un prurit et un rash, peuvent survenir au cours du traitement (voir rubriques 4.3 et 4.4).
Affections hépatobiliaires
Des altérations des paramètres hépatiques sont fréquentes. Une augmentation des transaminases sériques et de la bilirubine sérique, non liée à la dose, est fréquemment observée.
Une prise de poids rapide, une rétention de fluide avec de l’ascite, une hépatomégalie, associés à une augmentation rapide de la bilirubine sérique et une thrombocytopénie persistante peuvent indiquer un risque de développer une MVO sévère, qui peut être fatale si elle n’est pas traitée (voir rubrique 4.4).
Une infiltration graisseuse du foie est très fréquemment observée. De rares cas de cholestase, de jaunisse, de nécrose des cellules hépatiques et d’insuffisance hépatique d’issue fatale ont été rapportés.
Une altération de la synthèse protéique peut conduire à une diminution des protéines sériques. Chez la majorité des patients, on constate une diminution de la sérum-albumine pendant le traitement, non liée à la dose.
Les types d’effets indésirables d’Oncaspar sont semblables à ceux observés avec la L-asparaginase non pégylée native (c.-à-d. l’asparaginase native dérivée d’E. coli).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via :
Belgique
Agence fédérale des médicaments et des produits de santé
www.afmps.be
Division Vigilance
Site internet : www.notifieruneffetindesirable.be
E-mail : adr@fagg-afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy
ou Division de la pharmacie et des médicaments
de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHÉ
Les Laboratoires Servier
50, rue Carnot
92284 Suresnes Cedex
France
8. NUMÉRO(S) D’AUTORISATION DE MISE SUR LE MARCHÉ
EU/1/15/1070/002
10. DATE DE MISE À JOUR DU TEXTE
05/2024
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments http://www.ema.europa.eu.
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 3789708 | ONCASPAR 750U/ML PDR SOL INJ/PERF FL INJ 1 | L01XX24 | - | € 1565,8 | Oui | - | - |