RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
1. DÉNOMINATION DU MÉDICAMENT
IMFINZI, 50 mg/ml solution à diluer pour perfusion.
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque ml de solution à diluer pour perfusion contient 50 mg de durvalumab.
Un flacon de 2,4 ml de solution à diluer contient 120 mg de durvalumab.
Un flacon de 10 ml de solution à diluer contient 500 mg de durvalumab.
Le durvalumab est produit dans une lignée cellulaire de mammifères (ovaire de hamster chinois) par la technique de l’ADN recombinant.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Solution à diluer pour perfusion (concentré stérile).
Solution claire à opalescente, incolore à jaune pâle, exempte de toute particule visible. La solution a un pH d’approximativement 6,0 et une osmolalité d’environ 400 mOsm/kg.
4. INFORMATIONS CLINIQUES
4.1 Indications thérapeutiques
Cancer bronchique non à petites cellules (CBNPC)
IMFINZI, en association avec une chimiothérapie à base de platine en traitement néoadjuvant, suivi d'IMFINZI en monothérapie en traitement adjuvant, est indiqué dans le traitement des patients adultes atteints d'un cancer bronchique non à petites cellules (CBNPC) résécable, à haut risque de récidive et sans mutations de l'EGFR ni réarrangements ALK (pour les critères de sélection, voir rubrique 5.1).
IMFINZI est indiqué en monothérapie dans le traitement des patients adultes atteints d’un cancer bronchique non à petites cellules (CBNPC) localement avancé, non opérable, dont les tumeurs expriment PD-L1 ≥ 1% des cellules tumorales et dont la maladie n’a pas progressé après une chimioradiothérapie à base de platine (voir rubrique 5.1).
IMFINZI, en association avec le trémélimumab et une chimiothérapie à base de platine, est indiqué dans le traitement de première ligne des patients adultes atteints d’un CBNPC métastatique en l’absence de mutation activatrice de l’EGFR ou de ALK.
Cancer bronchique à petites cellules (CBPC)
IMFINZI est indiqué en monothérapie dans le traitement des patients adultes atteints d'un cancer bronchique à petites cellules de stade limité (CBPC-SL) dont la maladie n'a pas progressé après une chimioradiothérapie à base de platine.
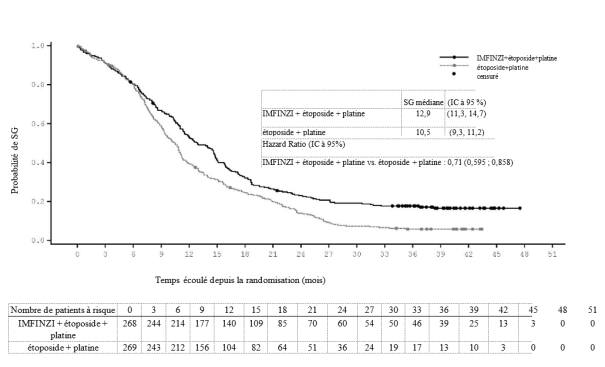
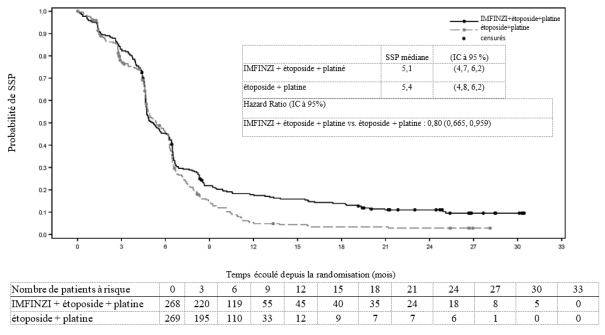
IMFINZI, en association à l’étoposide et au carboplatine ou au cisplatine, est indiqué dans le traitement de première intention des patients adultes atteints d'un cancer bronchique à petites cellules à un stade étendu (CBPC-SE).
Cancer des voies biliaires (CVB)
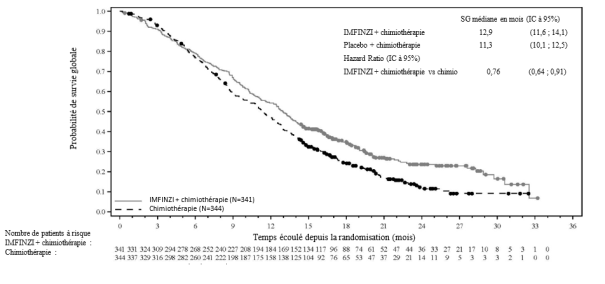
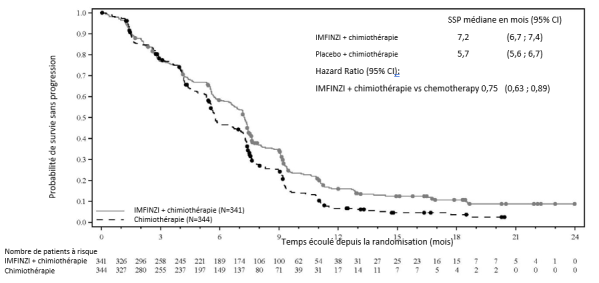
IMFINZI, en association avec la gemcitabine et le cisplatine est indiqué pour le traitement de première ligne des patients adultes atteints d’un cancer des voies biliaires (CVB) non résécable ou métastatique.
Carcinome hépatocellulaire (CHC)
IMFINZI est indiqué en monothérapie dans le traitement de première ligne des patients adultes atteints d'un carcinome hépatocellulaire (CHC) avancé ou non résécable.
IMFINZI, en association avec le trémélimumab, est indiqué dans le traitement de première ligne des patients adultes atteints d’un carcinome hépatocellulaire (CHC) avancé ou non résécable.
Cancer de l’endomètre
IMFINZI, en association au carboplatine et au paclitaxel est indiqué dans le traitement de première ligne des patientes adultes atteintes d’un cancer de l’endomètre avancé ou récurrent qui sont candidates à un traitement systémique, suivi d’un traitement d’entretien :
- IMFINZI en monothérapie dans le cancer de l’endomètre qui présente une déficience du système MMR (dMMR)
- IMFINZI en association à l’olaparib dans le cancer de l’endomètre qui ne présente pas de déficience du système MMR (pMMR).
Tumeur de la vessie infiltrant le muscle (TVIM)
IMFINZI en association avec la gemcitabine et le cisplatine en traitement néoadjuvant, suivi par IMFINZI en monothérapie en traitement adjuvant après une cystectomie radicale, est indiqué dans le traitement des patients adultes atteints d’une tumeur résécable de la vessie infiltrant le muscle (TVIM).
4.2 Posologie et mode d'administration
Le traitement doit être instauré et surveillé par un médecin ayant l’expérience du traitement des cancers.
Test des taux de PD-L1 chez les patients atteints d’un CBNPC localement avancé
Chez les patients atteints d’un CBNPC localement avancé éligibles à un traitement par IMFINZI, l’expression tumorale de PD-L1 doit être confirmée par un test validé (voir rubrique 5.1).
Test MMR chez les patientes atteintes d'un cancer de l'endomètre
Chez les patientes atteintes d'un cancer de l'endomètre éligibles à un traitement par IMFINZI, le statut tumoral MMR doit être confirmé par un test validé (voir rubrique 5.1).
Posologie
La dose recommandée d’IMFINZI en monothérapie et en association thérapeutique est présentée dans le Tableau 1. IMFINZI est administré sous forme de perfusion intraveineuse d’une durée d’1 heure.
Lorsque IMFINZI est administré en association avec d'autres agents thérapeutiques, il convient de se reporter au résumé des caractéristiques du produit (RCP) des agents thérapeutiques pour plus d’informations.
Tableau 1. Dose recommandée d’IMFINZI en monothérapie et en association thérapeutique
Indication | Dose recommandée d’IMFINZI | Durée du traitement |
Monothérapie | ||
CBNPC localement avancé | 10 mg/kg toutes les 2 semaines ou 1 500 mg toutes les 4 semainesa | Jusqu’à progression de la maladie ou toxicité inacceptable, ou pour une durée maximale de 12 moisb |
CBPC-SL | 1 500 mg toutes les 4 semainesa | Jusqu’à progression de la maladie ou toxicité inacceptable, ou pour une durée maximale de 24 mois |
CHC | 1 500 mg toutes les 4 semainesa | Jusqu’à progression de la maladie ou toxicité inacceptable |
Association thérapeutique | ||
CBNPC résécable | 1 500 mgc en association avec une chimiothérapie à base de platine toutes les 3 semaines jusqu’à 4 cycles avant la chirurgie, | Phase néoadjuvante : jusqu'à progression de la maladie empêchant une chirurgie définitive ou toxicité inacceptable. |
CBNPC métastatique | Au cours d’une chimiothérapie à base de platine : | Jusqu’à progression de la maladie ou toxicité inacceptable |
CBPC-SE | 1 500 mgh en association avec une chimiothérapie toutes les 3 semaines (21 jours) pendant 4 cycles, | Jusqu’à progression de la maladie ou toxicité inacceptable |
CVB | 1 500 mgj en association avec une chimiothérapie toutes les 3 semaines (21 jours) jusqu’à 8 cycles, | Jusqu’à progression de la maladie ou toxicité inacceptable |
CHC | 1 500 mgj d’IMFINZI administrés en association avec 300 mgj de trémélimumab en une seule dose au jour 1 du cycle 1, | Jusqu’à progression de la maladie ou toxicité inacceptable |
Cancer de l’endomètre | 1 120 mg en association au carboplatine et au paclitaxel toutes les 3 semaines (21 jours) pendant un minimum de 4 et jusqu’à 6 cycles, | Jusqu’à progression de la maladie ou toxicité inacceptable |
TVIM | 1500 mgl en association à la chimiothérapie toutes les 3 semaines pendant 4 cycles avant la chirurgie, | Phase néoadjuvante : jusqu’à progression de la maladie empêchant une chirurgie définitive ou toxicité inacceptable |
a Chez les patients pesant 30 kg ou moins, la dose doit être établie en fonction du poids, équivalant à 10 mg/kg d’IMFINZI toutes les 2 semaines ou 20 mg/kg toutes les 4 semaines en monothérapie jusqu’à ce que le poids soit supérieur à 30 kg.
b Il est recommandé de poursuivre le traitement chez les patients cliniquement stables présentant des signes de progression de la maladie jusqu’à ce que la progression de la maladie soit confirmée.
c Chez les patients atteints d'un CBNPC résécable et pesant 30 kg ou moins, la dose doit être établie en fonction du poids équivalent à 20 mg/kg d'IMFINZI. En association avec une dose de chimiothérapie à base de platine à 20 mg/kg toutes les 3 semaines (21 jours) avant la chirurgie, suivie d'une monothérapie à 20 mg/kg toutes les 4 semaines après la chirurgie jusqu'à ce que le poids soit supérieur à 30 kg.
d Chez les patients ayant un CBNPC métastatique et pesant 30 kg ou moins, la dose doit être établie en fonction du poids équivalent à 20 mg/kg d'IMFINZI jusqu'à ce que le poids soit supérieur à 30 kg. Chez les patients pesant 34 kg ou moins, la dose doit être établie en fonction du poids équivalent à 1 mg/kg de trémélimumab jusqu'à ce que le poids soit supérieur à 34 kg.
e Envisager un traitement d'entretien par pémétrexed pour les patients atteints de tumeurs non épidermoïdes qui ont reçu un traitement par pémétrexed et carboplatine/cisplatine pendant la phase de chimiothérapie à base de platine.
f En cas de retard de dose(s), une cinquième dose de trémélimumab peut être administrée après la semaine 16, en même temps qu’IMFINZI.
g Si les patients reçoivent moins de 4 cycles de chimiothérapie à base de platine, les cycles restants de trémélimumab (jusqu'à un total de 5) en association avec IMFINZI doivent être administrés pendant la phase de chimiothérapie post-platine.
h Chez les patients ayant un CBPC-SE et pesant 30 kg ou moins, la dose doit être établie en fonction du poids à 20 mg/kg d’IMFINZI. En association avec une dose de chimiothérapie toutes les 3 semaines (21 jours), suivis de 20 mg/kg toutes les 4 semaines en monothérapie jusqu’à ce que le poids soit supérieur à 30 kg.
i Chez les patients ayant un CVB et pesant 36 kg ou moins, la dose doit être établie en fonction du poids à 20 mg/kg d’IMFINZI. En association avec une dose de chimiothérapie toutes les 3 semaines (21 jours), suivi de 20 mg/kg toutes les 4 semaines en monothérapie jusqu’à ce que le poids soit supérieur à 36 kg.
j Chez les patients ayant un CHC et pesant 30 kg ou moins, la dose doit être établie en fonction du poids équivalent à 20 mg/kg d’IMFINZI jusqu’à ce que le poids soit supérieur à 30 kg. Chez les patients pesant 40 kg ou moins, la dose doit être établie en fonction du poids équivalent à 4 mg/kg de trémélimumab jusqu’à ce que le poids soit supérieur à 40 kg.
k Chez les patientes atteintes d’un cancer de l’endomètre et pesant 30 kg ou moins pendant la phase d’entretien, la dose doit être établie en fonction du poids, équivalent à 20 mg/kg d’IMFINZI, jusqu’à ce que le poids soit supérieur à 30 kg.
l Chez les patients atteints d’un TVIM et pesant 30 kg ou moins, la dose doit être établie en fonction du poids à 20 mg/kg d’IMFINZI.
Une augmentation ou une réduction de la dose n’est pas recommandée. La suspension ou l’arrêt du traitement peut être requis sur la base de la sécurité et la tolérance individuelles, voir tableau 2.
Les recommandations relatives au traitement des effets indésirables à médiation immunitaire et non à médiation immunitaire sont décrites dans le tableau 2 (voir rubrique 4.4 pour d'autres recommandations de prise en charge, d’information de surveillance et d'évaluation).
Tableau 2. Modifications de traitement pour IMFINZI ou IMFINZI en association avec d’autres médicaments
Effets indésirables | Intensitéa | Modification du traitement |
Effets indésirables à médiation immunitaire | ||
Pneumopathie à médiation immunitaire / pneumopathie interstitielle | Grade 2 | Suspendre le traitement |
Grade 3 ou 4 | Arrêter définitivement | |
Hépatite à médiation immunitaire | ALAT ou ASAT > 3 ‑ ≤5 x LSN ou bilirubine totale > 1,5 - ≤ 3 x LSN | Suspendre le traitement |
ALAT ou ASAT > 5 - ≤ 10 x LSN | Suspendre IMFINZI et arrêter définitivement le trémélimumab (le cas échéant) | |
ALAT ou ASAT > 3 x LSN concomitant avec bilirubine totale > 2 x LSNb | Arrêter définitivement | |
ALAT ou ASAT > 10 x LSN ou bilirubine totale > 3 x LSN | ||
Hépatite à médiation immunitaire dans le cadre d’un CHC (ou envahissement tumoral secondaire du foie avec des valeurs initiales anormales)c | ALAT ou ASAT > 2,5 - ≤ 5 x VI et ≤ 20 x LSN | Suspendre le traitement |
ALAT ou ASAT > 5 - 7 x VI et ≤ 20 x LSN | Suspendre IMFINZI et arrêter définitivement le trémélimumab (le cas échéant) | |
ALAT ou ASAT > 7 x VI ou > 20 x LSN | Arrêter définitivement | |
Colite ou diarrhée à médiation immunitaire | Grade 2 | Suspendre le traitement |
Grade 3 pour IMFINZI en monothérapie | Suspendre le traitement | |
Grade 3 pour IMFINZI + trémélimumab | Arrêter définitivement | |
Grade 4 | Arrêter définitivement | |
Perforation intestinalee | Tout grade | Arrêter définitivement |
Hyperthyroïdie à médiation immunitaire, thyroïdite | Grade 2 - 4 | Suspendre le traitement jusqu’à l’obtention d’un état clinique stable |
Hypothyroïdie à médiation immunitaire | Grade 2 - 4 | Pas de changements |
Insuffisance surrénalienne à médiation immunitaire ou hypophysite / hypopituitarisme | Grade 2 - 4 | Suspendre le traitement jusqu’à l’obtention d’un état clinique stable |
Diabète sucré de type 1 à médiation immunitaire | Grade 2 - 4 | Pas de changements |
Néphrite à médiation immunitaire | Grade 2 avec créatininémie > 1,5 - 3 x (LSN ou valeur initiale) | Suspendre le traitement |
Grade 3 avec une créatininémie > 3 x la valeur initiale ou > 3‑6 x LSN ; grade 4 avec une créatininémie > 6 x LSN | Arrêter définitivement | |
Eruption cutanée ou dermatite à médiation immunitaire (incluant pemphigoïde) | Grade 2 pendant > 1 semaine | Suspendre le traitement |
Grade 3 | ||
Grade 4 | Arrêter définitivement | |
Myocardite à médiation immunitaire | Grade 2 - 4 | Arrêter définitivement |
Myosite / Polymyosite/ Rhabdomyolyse à médiation immunitaire | Grade 2 ou 3 | Suspendre le traitementf |
Grade 4 | Arrêter définitivement | |
Réactions liées à la perfusion | Grade 1 ou 2 | Arrêter ou ralentir la vitesse de perfusion |
Grade 3 ou 4 | Arrêter définitivement | |
Infection | Grade 3 ou 4 | Suspendre le traitement jusqu’à l’obtention d’un état clinique stable |
Myasthénie grave à médiation immunitaire | Grade 2 - 4 | Arrêter définitivement |
Myélite transverse à médiation immunitaire | Tous grades confondus | Arrêter définitivement |
Méningite à médiation immunitaire | Grade 2 | Suspendre le traitement |
Grade 3 ou 4 | Arrêter définitivement | |
Encéphalite à médiation immunitaire | Grade 2 - 4 | Arrêter définitivement |
Syndrome de Guillain Barré à médiation immunitaire | Grade 2 - 4 | Arrêter définitivement |
Autres effets indésirables à médiation immunitaireg | Grade 2 ou 3 | Suspendre le traitement |
Grade 4 | Arrêter définitivement | |
Effets indésirables non à médiation immunitaire | ||
Aplasie pure des globules rouges (érythroblastopénie)h | Tous grades confondus | Arrêter définitivement |
Autres effets indésirables non à médiation immunitaire | Grade 2 et 3 | Suspendre le traitement jusqu’au retour à un grade ≤ 1 ou retour à la situation initiale |
Grade 4 | Arrêter définitivementi | |
a Critères communs de terminologie pour les événements indésirables, version 4.03. ALAT : alanine aminotransférase ; ASAT : aspartate aminotransférase ; LSN : limite supérieure de la normale ; VI : valeur initiale.
b Pour les patients ayant une autre cause, suivre les recommandations pour les augmentations de l'ASAT ou de l'ALAT sans élévation simultanée de la bilirubine.
c Si l'ASAT et l'ALAT sont inférieures ou égales à la LSN basale chez les patients présentant une atteinte hépatique, suspendre ou arrêter définitivement le durvalumab en fonction des recommandations pour les hépatites sans atteinte hépatique
d Arrêter définitivement le traitement par le trémélimumab en cas d’évènement de grade 3 ; cependant, le traitement par le durvalumab peut être repris une fois l'évènement résolu.
e L’effet indésirable est uniquement associé à IMFINZI en association avec le trémélimumab.
f Arrêter définitivement IMFINZI si les effets indésirables ne se résolvent pas en grade ≤ 1 dans les 30 jours ou s’il y a des signes d’insuffisance respiratoire.
g Inclut thrombopénie immunitaire, pancréatite, arthrite à médiation immunitaire, uvéite, cystite non infectieuse et pseudopolyarthrite rhizomélique.
h L’effet indésirable est uniquement associé lorsque le traitement d’entretien par l’olaparib est utilisé en association avec IMFINZI, après un traitement par IMFINZI en association à une chimiothérapie à base de platine
i À l'exception des anomalies biologiques de grade 4, pour lesquelles la décision d'arrêter le traitement doit être fondée sur les signes/symptômes cliniques qui les accompagnent et sur le jugement clinique.
En fonction de l’intensité de l’effet indésirable, IMFINZI et/ou le trémélimumab devront être suspendus et des corticoïdes devront être administrés (voir rubrique 4.4). Après suspension, IMFINZI et/ou le trémélimumab peuvent être repris dans les 12 semaines si les effets indésirables se sont améliorés jusqu’à un grade ≤ 1 et la dose de corticoïdes a été réduite à ≤ 10 mg de prednisone ou équivalent par jour. IMFINZI et/ou le trémélimumab devront être définitivement arrêtés pour les effets indésirables à médiation immunitaire récurrents de grade 3 (sévères) et pour tout effet indésirable à médiation immunitaire de grade 4 (menaçant le pronostic vital), à l’exception des endocrinopathies contrôlées par un traitement hormonal de substitution.
Populations particulières
Sujet âgé
Aucune adaptation posologique n’est requise chez le sujet âgé (≥ 65 ans) (voir rubrique 5.1).
Insuffisance rénale
Aucune adaptation posologique d’IMFINZI n’est recommandée pour les patients présentant une insuffisance rénale légère ou modérée. Chez les patients atteints d’une insuffisance rénale sévère, les données sont trop limitées pour tirer des conclusions sur cette population (voir rubrique 5.2).
Insuffisance hépatique
Aucune adaptation posologique d’IMFINZI n’est recommandée pour les patients présentant une insuffisance hépatique légère ou modérée. Les données disponibles chez les patients présentant une insuffisance hépatique sévère sont trop limitées pour établir des conclusions chez cette population (voir rubrique 5.2).
Population pédiatrique
La sécurité et l’efficacité d’IMFINZI chez les enfants et les adolescents âgés de moins de 18 ans n’ont pas été établies en ce qui concerne le CBNPC, le CBPC, le CVB et le CHC. Aucune donnée n’est disponible. En dehors de ses indications autorisées, IMFINZI en association avec le trémélimumab a été étudié chez des enfants âgés de 1 à 17 ans atteints de neuroblastome, de tumeur solide et de sarcome, cependant les résultats de l’étude ne permettent pas de conclure que les bénéfices d’une telle utilisation l’emportent sur les risques. Les données actuellement disponibles sont décrites aux rubriques 5.1 et 5.2.
Mode d’administration
IMFINZI est destiné à une utilisation intraveineuse. Il doit être administré en perfusion intraveineuse sur une durée d’1 heure (voir rubrique 6.6).
Pour les instructions concernant la dilution du médicament avant administration, voir la rubrique 6.6.
IMFINZI en association avec une chimiothérapie
Lorsqu’IMFINZI est administré en association avec une chimiothérapie, IMFINZI est administré avant la chimiothérapie le même jour.
IMFINZI en association avec le trémélimumab et une chimiothérapie à base de platine
Lorsqu’IMFINZI est administré en association avec le trémélimumab et une chimiothérapie à base de platine, le trémélimumab est administré en premier, puis IMFINZI, et enfin la chimiothérapie à base de platine le même jour.
Lorsqu’IMFINZI est administré en association avec une cinquième dose de trémélimumab et avec un traitement d’entretien par pémétrexed à la semaine 16, le trémélimumab est administré en premier, puis IMFINZI, et enfin le traitement d’entretien par pémétrexed le même jour.
IMFINZI, le trémélimumab et la chimiothérapie à base de platine sont administrés sous forme de perfusions intraveineuses distinctes. IMFINZI et le trémélimumab sont administrés chacun sur une durée d’une heure. Pour la chimiothérapie à base de platine, se reporter au RCP pour plus d’informations sur l’administration. Pour le traitement d’entretien par pémétrexed, se reporter au RCP pour plus d’informations sur l’administration. Il convient d’utiliser des poches et des filtres de perfusion distincts à chaque perfusion.
Durant le cycle 1, la perfusion de trémélimumab doit être suivie de la perfusion d’IMFINZI qui doit débuter environ 1 heure (2 heures maximum) après la fin de la perfusion de trémélimumab. La perfusion de chimiothérapie à base de platine doit débuter environ 1 heure (2 heures au maximum) après la fin de la perfusion d’IMFINZI. En l’absence de problème cliniquement significatif au cours du cycle 1, les cycles suivants d’IMFINZI peuvent, à la discrétion du médecin, être administrés immédiatement après le trémélimumab et la durée qui sépare la fin de la perfusion d’IMFINZI et le début de la chimiothérapie peut être réduite à 30 minutes.
IMFINZI en association avec le trémélimumab
Pour le CHC non résécable, lorsqu’IMFINZI est administré en association avec le trémélimumab, administrer le trémélimumab avant IMFINZI, le même jour. IMFINZI et trémélimumab sont administrés sous forme de perfusions intraveineuses distinctes. Voir le RCP du trémélimumab pour plus d’informations concernant l’administration de ce médicament.
4.3 Contre-indications
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.8 Effets indésirables
Résumé du profil de tolérance
IMFINZI en monothérapie
La tolérance d’IMFINZI en monothérapie repose sur les données poolées obtenues chez 4 642 patients présentant de nombreux types de tumeurs. IMFINZI a été administré à une dose de 10 mg/kg toutes les 2 semaines, de 20 mg/kg toutes les 4 semaines ou de 1 500 mg toutes les 4 semaines. Les effets indésirables les plus fréquents (>10 %) étaient : toux/toux productive (18,1 %), diarrhées (15,1 %), éruption cutanée (15,0 %), arthralgie (12,4 %), fièvre (12,5 %), douleur abdominale (11,8 %), infections des voies respiratoires supérieures (11,8%), prurit (11,1 %) et hypothyroïdie (11,6%). Les effets indésirables de Grade CTCAE ≥ 3 les plus fréquents (> 2 %) ont été la pneumonie (3,4 %) et l’aspartate aminotransférase augmentée ou l’alanine aminotransférase augmentée (2,5 %).
Le traitement par IMFINZI a été arrêté pour cause d’effets indésirables chez 3,9 % des patients. Les effets indésirables les plus fréquents ayant conduit à l’arrêt du traitement étaient la pneumopathie inflammatoire (1,1 %) et la pneumonie (0,8 %).
Le traitement par IMFINZI a été différé ou interrompu pour cause d’effets indésirables chez 13,1 % des patients. Les effets indésirables les plus fréquents ayant conduit au report ou à l’interruption du traitement étaient la pneumonie (2,3 %) et l’aspartate aminotransférase augmentée/alanine aminotransférase augmentée (2,0 %).
La tolérance d’IMFINZI en monothérapie chez les patients traités pour un CHC repose sur les données obtenues chez 492 patients et correspond au profil de tolérance global du groupe traité par IMFINZI en monothérapie (N = 4 642). Les effets indésirables les plus fréquents (> 10 %) étaient l’aspartate aminotransférase augmentée/alanine aminotransférase augmentée (20,3 %), douleurs abdominales (17,9 %), diarrhées (15,9 %), prurit (15,4 %) et éruption cutanée (15,2 %). Les effets indésirables de grade ≥ 3 les plus fréquents (> 2 %) ont été l’aspartate aminotransférase augmentée ou l’alanine aminotransférase augmentée (8,1 %) et les douleurs abdominales (2,2 %).
Le traitement par IMFINZI a été arrêté pour cause d'effets indésirables chez 3,7 % des patients. Les effets indésirables les plus fréquents ayant conduit à l'arrêt du traitement étaient l’aspartate aminotransférase augmentée/alanine aminotransférase augmentée (0,8 %) et l'hépatite (0,6 %).
Le traitement par IMFINZI a été différé ou interrompu pour cause d'effets indésirables chez 11,6 % des patients. L'effet indésirable le plus fréquent ayant conduit au report ou à l’interruption du traitement était l’aspartate aminotransférase augmentée/alanine aminotransférase augmentée (5,9 %).
IMFINZI en association avec la chimiothérapie
La tolérance d’IMFINZI administré en association avec une chimiothérapie repose sur les données poolées chez 1769 patients de 5 études (TOPAZ-1, CASPIAN, DUO-E, AEGEAN et NIAGARA). Les effets indésirables les plus fréquents (> 10 %) étaient les suivants : neutropénie (41,7 %), anémie (40,8 %), nausées (40,1 %), fatigue (39,6 %), constipation (29,7 %), diminution de l’appétit (22,2 %), thrombopénie (21,5 %), alopécie (19,7 %), éruption cutanée (19,7 %), diarrhée (18,2 %), vomissements (16,8 %), douleurs abdominales (16,7 %), neuropathie périphérique (16,3 %), leucopénie (14,8 %), fièvre (14,0 %), prurit (13,0 %), hypothyroïdisme (11,9 %), arthralgie (11,5 %), toux/toux productive (11,0 %) et aspartate aminotransférase augmentée ou alanine aminotransférase augmentée (10,7 %). Les effets indésirables de grade CTCAE ≥ 3 les plus fréquents (> 2 %) ont été la neutropénie (25,2 %), l’anémie (13,7 %), la thrombopénie (6,9 %), la leucopénie (4,5 %), la fatigue (2,8 %), la pneumonie (2,4 %) et la neutropénie fébrile (2,1 %).
Le traitement par IMFINZI a été arrêté pour cause d’effets indésirables chez 6,2 % des patients. Les effets indésirables les plus fréquents ayant conduit à l’arrêt du traitement étaient l’éruption cutanée (0,7 %), la pneumopathie inflammatoire (0,7 %) et la fatigue (0,6 %).
Le traitement par IMFINZI a été différé ou interrompu pour cause d’effets indésirables chez 29,2 % des patients. Les effets indésirables les plus fréquents ayant conduit à l’interruption du traitement étaient la neutropénie (12,6 %), la thrombopénie (4,5 %), l’anémie (3,9 %) et la leucopénie (2,1 %).
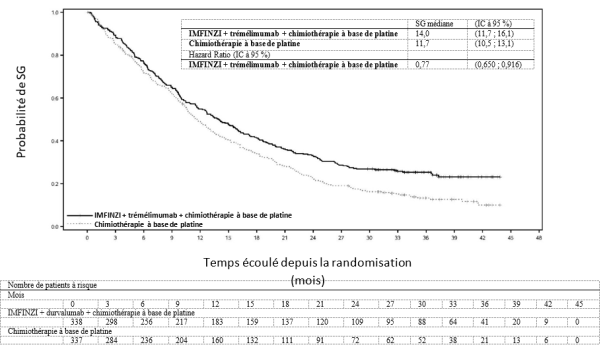
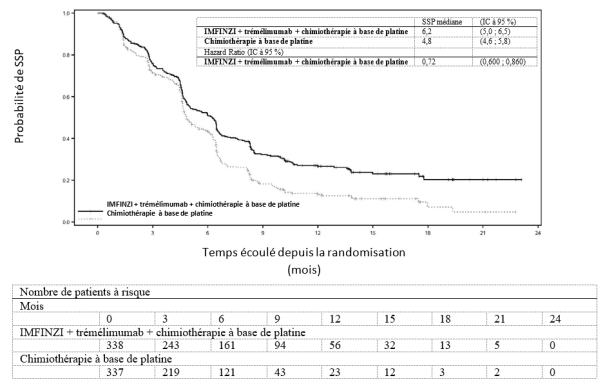
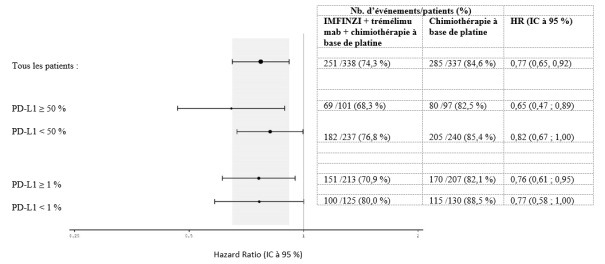
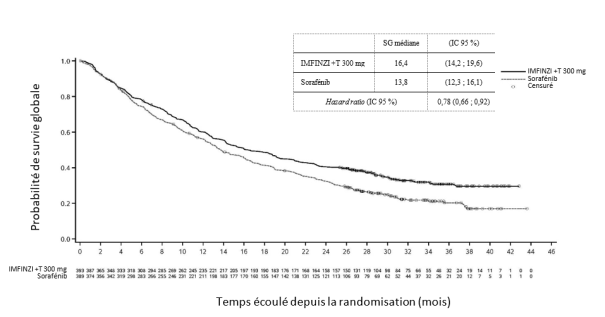
IMFINZI en association avec le trémélimumab 75 mg et une chimiothérapie à base de platine
La tolérance d’IMFINZI administré en association avec le trémélimumab 75 mg et une chimiothérapie repose sur les données chez 330 patients ayant un CBNPC métastatique. Les effets indésirables les plus fréquents (> 20 %) étaient les suivants : anémie (49,7 %), nausées (41,5 %), neutropénie (41,2 %), fatigue (36,1 %), éruption cutanée (25,8 %), thrombopénie (24,5 %) et diarrhée (21,5%). Les effets indésirables de grade CTCAE ≥ 3 les plus fréquents (> 2 %) ont été la neutropénie (23,9 %), l’anémie (20,6 %), la pneumonie (9,4 %), la thrombopénie (8,2 %), la leucopénie (5,5 %), la fatigue (5,2 %), la lipase augmentée (3,9 %), l’amylase augmentée (3,6 %), la neutropénie fébrile (2,4 %), la colite (2,1 %) et l’aspartate aminotransférase augmentée ou l’alanine aminotransférase augmentée (2,1 %).
Le traitement par IMFINZI a été arrêté pour cause d’effets indésirables chez 8,5 % des patients. Les effets indésirables les plus fréquents ayant conduit à l’arrêt du traitement étaient la pneumonie (2,1 %) et la colite (1,2 %).
Le traitement par IMFINZI a été interrompu pour cause d’effets indésirables chez 49,4 % des patients. Les effets indésirables les plus fréquents ayant conduit à l’interruption du traitement étaient la neutropénie (16,1 %), l’anémie (10,3 %), la thrombopénie (7,3 %), la leucopénie (5,8 %), la pneumonie (5,2 %), l’aspartate aminotransférase augmentée ou l’alanine aminotransférase augmentée (4,8 %), la colite (3,3 %) et la pneumopathie inflammatoire (3,3 %).
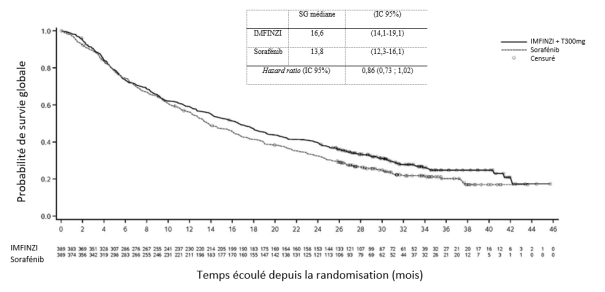
IMFINZI en association avec le trémélimumab 300 mg
La tolérance d’IMFINZI administré en association avec une dose unique de 300 mg de trémélimumab repose sur les données poolées (pool CHC) obtenues chez 462 patients atteints de CHC ayant participé à l’étude HIMALAYA et à une autre étude conduite chez des patients atteints de CHC, l’étude 22. Les effets indésirables les plus fréquents (> 10 %) étaient les suivants : éruption cutanée (32,5 %), prurit (25,5 %), diarrhée (25,3 %), douleur abdominale (19,7 %), aspartate aminotransférase augmentée ou l’alanine aminotransférase augmentée (18,0 %), fièvre (13,9 %), hypothyroïdie (13,0 %), toux/toux productive (10,8 %), œdème périphérique (10,4 %) et lipase augmentée (10,0 %) (voir Tableau 4). Les effets indésirables graves les plus fréquents (Grade CTCAE ≥ 3) étaient l’aspartate aminotransférase augmentée ou l’alanine aminotransférase augmentée (8,9 %), la lipase augmentée (7,1 %), l’amylase augmentée (4,3 %) et la diarrhée (3,9 %).
Les effets indésirables graves les plus fréquents étaient la colite (2,6 %), la diarrhée (2,4 %), la pneumonie (2,2 %) et l'hépatite (1,7 %).
Le traitement de l’étude a été arrêté pour cause d’effets indésirables chez 6,5 % des patients. Les effets indésirables les plus fréquents ayant conduit à l’arrêt du traitement étaient les suivants : hépatite (1,5 %) et aspartate aminotransférase augmentée/alanine aminotransférase augmentée (1,3 %).
La gravité des effets indésirables des médicaments a été évaluée sur la base du CTCAE, définissant le grade 1=léger, le grade 2=modéré, le grade 3=sévère, le grade 4=menace vitale et le grade 5=décès.
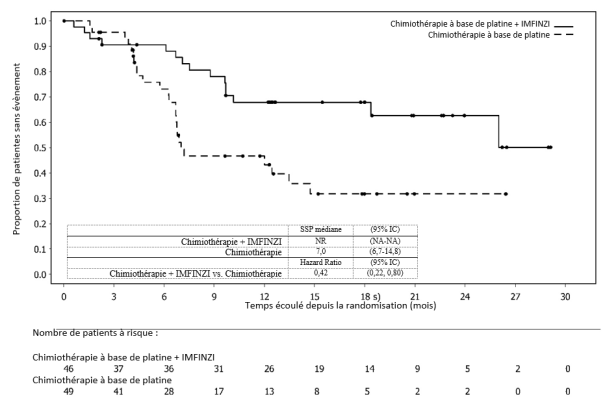
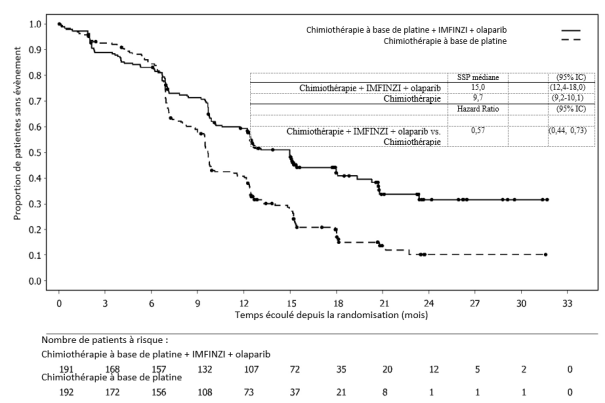
IMFINZI en association à une chimiothérapie à base de platine suivi d’IMFINZI en association à l’olaparib 300 mg deux fois par jour
La tolérance d’IMFINZI administré en association à une chimiothérapie à base de platine suivi d’IMFINZI en association à l’olaparib 300 mg deux fois par jour repose sur les données obtenues chez 238 patientes atteintes d’un cancer de l’endomètre.
Les effets indésirables les plus fréquents (> 20 %) étaient l'anémie (61,8 %), les nausées (54,6 %), la fatigue (54,2 %), la neuropathie périphérique (51,7 %), l'alopécie (50,8 %), la neutropénie (39,5 %), la constipation (32,8 %), la thrombopénie (29,8 %), la diarrhée (28,2 %), les vomissements (25,6 %), l’arthralgie (24,4 %), l’éruption cutanée (23,5 %), les douleurs abdominales (23,5 %), la diminution de l'appétit (23,1 %) et la leucopénie (20,2 %).
Les effets indésirables les plus fréquents (> 2 %) de grade NCI CTCAE ≥ 3 étaient la neutropénie (25,2 %), l'anémie (23,5 %), la leucopénie (6,7 %), la thrombopénie (5,9 %), la fatigue (5,5 %), la neutropénie fébrile (3,4 %), les nausées (2,9 %), l'aspartate aminotransférase augmentée/alanine aminotransférase augmentée (2,9 %) et la neuropathie périphérique (2,5 %).
IMFINZI a été arrêté chez 4,6 % des patientes. L'effet indésirable le plus fréquent ayant conduit à l'arrêt du traitement était la pneumopathie (1,7 %).
IMFINZI a été interrompu chez 38,2 % des patientes. Les effets indésirables les plus fréquents ayant conduit à une interruption du traitement étaient l'anémie (13,4 %), la thrombopénie (11,8 %), la neutropénie (10,1 %), la leucopénie (2,9 %), l'hypothyroïdie (2,1 %) et l'infection des voies respiratoires supérieures (2,1 %).
Liste tabulée des effets indésirables
Le tableau 3 liste l’incidence des effets indésirables de l’ensemble des données poolées de tolérance pour IMFINZI en monothérapie (n= 4 642), chez les patients traités par IMFINZI en association avec une chimiothérapie (n= 1769) et chez les patients traités par IMFINZI en association avec une chimiothérapie à base de platine suivie d'IMFINZI en association à l'olaparib (chimiothérapie à base de platine + IMFINZI + olaparib) (n = 238). Sauf indication contraire, le tableau 4 liste l'incidence des effets indésirables chez les patients traités par IMFINZI en association avec le trémélimumab 75 mg et une chimiothérapie à base de platine dans l'étude POSEIDON (N=330) et chez les patients traités par IMFINZI en association avec une dose unique de trémélimumab 300 mg dans le pool CHC (N=462). Les effets indésirables sont classés selon la classe de systèmes d’organes de MedDRA. Au sein des classes de systèmes d’organes, les effets indésirables sont présentés suivant un ordre de fréquence décroissant. La catégorie de fréquence correspondante pour chaque effet indésirable est définie comme : très fréquent (≥1/10), fréquent (≥1/100 à < 1/10), peu fréquent (≥ 1/1 000 à < 1/100), rare (≥ 1/10 000 à < 1/1 000), très rare (< 1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles). Dans chaque groupement de fréquence, les effets indésirables sont présentés par ordre de gravité décroissant.
Tableau 3. Effets indésirables chez les patients traités par IMFINZI
| IMFINZI en monothérapie | IMFINZI en association avec une chimiothérapie | Chimiothérapie à base de platine + IMFINZI + olaparib* |
Infections et infestations | |||
Très fréquent | Infections des voies respiratoires supérieuresa |
| Infections des voies respiratoires supérieuresa |
Fréquent | Pneumonieb,c, Grippe, Candidose orale, Infections dentaires et des tissus mous buccauxd | Pneumonieb,c, Infections des voies respiratoires supérieuresa, Infections dentaires et des tissus mous buccauxd | Pneumonie, Candidose orale, Infections dentaires et des tissus mous buccauxd |
Peu fréquent |
| Candidose orale, Grippe | Grippe |
Affections hématologiques et du système lymphatique | |||
Très fréquent |
| Anémie, Leucopéniee, Neutropénief, Thrombopénieg | Anémieh, Leucopénieh, Neutropénieh, Thrombopénieh, |
Fréquent |
| Neutropénie fébrile, | Aplasie pure des globules rouges (érythroblastopénie), Neutropénie fébrileh, Lymphopéniei, |
Peu fréquent | Thrombopénie immunitairec | Pancytopéniec | Pancytopénieh |
Rare |
| Thrombopénie immunitaire |
|
Affections du système immunitaire | |||
Fréquent |
|
| Hypersensibilitéi,j |
Affections endocriniennes | |||
Très fréquent | Hypothyroïdiek | Hypothyroïdiek | Hypothyroïdie |
Fréquent | Hyperthyroïdiel | Hyperthyroïdiel, | Hyperthyroïdie, Thyroïdite |
Peu fréquent | Thyroïditem, Insuffisance surrénalienne, Hypopituitarisme/hypophysite, Diabète sucré de type 1 | Insuffisance surrénalienne, Diabète sucré de type 1, Hypopituitarisme/hypophysite, Thyroïditem |
|
Rare | Diabète insipide |
|
|
Affections oculaires | |||
Peu fréquent |
| Uvéite | Uvéite |
Rare | Uvéite |
|
|
Affections du métabolisme et de la nutrition | |||
Très fréquent |
| Diminution de l’appétit | Diminution de l’appétith |
Affections du système nerveux | |||
Très fréquent |
| Neuropathie périphériquen | Neuropathie périphérique, Sensation vertigineusei, Céphaléesi, Dysgueusiei,o |
Peu fréquent | Myasthénie grave, Encéphalitec,p | Myasthénie grave |
|
Rare | Méningite | Encéphalitep |
|
Fréquence indéterminée | Syndrome de Guillain-Barré, Myélite transverseq |
|
|
Affections vasculaires | |||
Fréquent |
|
| Evènements thrombo-emboliques veineuxi,r |
Affections cardiaques | |||
Peu fréquent | Myocardite | Myocarditec |
|
Affections respiratoires, thoraciques et médiastinales | |||
Très fréquent | Toux / toux productive | Toux / toux productive | Toux / toux productive, Dyspnéei,s |
Fréquent | Pneumopathie inflammatoirec,t, Dysphonie | Pneumopathie inflammatoirec,t, Dysphonie | Pneumopathie inflammatoire, Dysphonie |
Peu fréquent | Pneumopathie interstitielle diffuse | Pneumopathie interstitielle diffusec | Pneumopathie interstitielle diffuse |
Affections gastro-intestinales | |||
Très fréquent | Diarrhées, Douleurs abdominalesu | Diarrhées, Douleurs abdominalesu, Constipation, Nausées, Vomissements | Diarrhées, Douleurs abdominalesu, Constipationh, Nauséesh, Vomissementsh, Stomatiteh |
Fréquent |
| Stomatitev, Colitew | Dyspepsiei, Colitew |
Peu fréquent | Colitec,w, Pancréatitex | Pancréatitex |
|
Rare | Maladie cœliaqueq, Insuffisance pancréatique exocrine | Maladie cœliaqueq, Insuffisance pancréatique exocrine |
|
Affections hépatobiliaires | |||
Très fréquent |
| Aspartate aminotransférase augmentée ou Alanine aminotransférase augmentéey | Aspartate aminotransférase augmentée ou Alanine aminotransférase augmentée |
Fréquent | Hépatitec,z, Aspartate aminotransférase augmentée ou Alanine aminotransférase augmentéec,y | Hépatitec,z |
|
Peu fréquent |
|
| Hépatitez |
Affections de la peau et du tissu sous-cutané | |||
Très fréquent | Eruption cutanéeaa, Prurit | Eruption cutanéeaa, Alopécie, Prurit | Eruption cutanéeaa, Alopécieh, Prurit |
Fréquent | Sueurs nocturnes | Dermatite | Dermatitebb |
Peu fréquent | Dermatite, Psoriasis, Pemphigoïdecc | Pemphigoïdecc, Sueurs nocturnes, Psoriasis | Sueurs nocturnes |
Affections musculo-squelettiques et du tissu conjonctif | |||
Très fréquent | Arthralgie | Arthralgie | Arthralgieh, Myalgie |
Fréquent | Myalgie | Myalgie |
|
Peu fréquent | Myositedd , Arthrite à médiation immunitaireee | Arthrite à médiation immunitaireee, Myositedd | Myosite |
Rare | Polymyositeff , Pseudopolyarthrite rhizomélique | Pseudopolyarthrite rhizoméliquegg | Pseudopolyarthrite rhizoméliquegg |
Affections du rein et des voies urinaires | |||
Très fréquent |
|
| Créatinine sanguine augmentée |
Fréquent | Créatinine sanguine augmentée, Dysurie | Créatinine sanguine augmentée, Dysurie | Dysurie |
Peu fréquent | Néphritehh, Cystite non infectieuse | Cystite non infectieuse, Néphritehh | Cystite non infectieuseh |
Troubles généraux et anomalies au site d’administration | |||
Très fréquent | Fièvre | Fièvre, Fatigueii, | Fièvre, Fatigueh, Œdème périphériquejj |
Fréquent | Œdème périphériquejj | Œdème périphériquejj |
|
Lésions, intoxication et complications liées aux procédures | |||
Fréquent | Réaction liée à la perfusionkk | Réaction liée à la perfusionkk | Réaction liée à la perfusion |
La fréquence des effets indésirables peut ne pas être entièrement attribuée au durvalumab seul, mais peut contenir des contributions de la maladie sous-jacente ou d'autres médicaments utilisés en association.
* étude globale d'un traitement comprenant jusqu'à six cycles de 21 jours par chimiothérapie à base de platine en association avec IMFINZI, suivi d'IMFINZI en association avec l'olaparib.
a inclut laryngite, nasopharyngite, abcès périamygdalien, pharyngite, rhinite, sinusite, angine, trachéobronchite et infection des voies respiratoires supérieures.
b inclut pneumonie à Pneumocystis jirovecii, pneumonie, pneumonie à adénovirus, pneumonie bactérienne, pneumonie à cytomégalovirus, pneumonie à haemophilus, pneumonie à pneumocoques, pneumonie à streptocoques, pneumonie à candida, pneumonie à klebsiella et pneumonie à legionella.
c y compris d’issue fatale.
d inclut gingivite, infection buccale, parodontite, pulpite dentaire, abcès dentaire et infection dentaire.
e inclut leucopénie et globules blancs diminués.
f inclut neutropénie et neutrophiles diminués.
g inclut thrombopénie et numération plaquettaire diminuée.
h les effets indésirables ne s’appliquent qu’à la chimiothérapie dans l’étude DUO-E.
i les effets indésirables ne s’appliquent qu’à l’olaparib dans l’étude DUO-E.
j inclut hypersensibilité médicamenteuse et hypersensibilité.
k inclut hypothyroïdie auto-immune, hypothyroïdie, hypothyroïdie à médiation immunitaire et augmentation de l'hormone thyréostimulante dans le sang.
l inclut hyperthyroïdie, maladie de Graves, hyperthyroïdie à médiation immunitaire et diminution de l'hormone thyréostimulante dans le sang.
m inclut thyroïdite auto-immune, thyroïdite à médiation immunitaire, thyroïdite et thyroïdite subaiguë.
n inclut neuropathie périphérique, paresthésie et neuropathie sensorielle périphérique.
o inclut dysgueusie et trouble du goût
p inclut encéphalite, encéphalite auto-immune, encéphalite à médiation immunitaire et encéphalite non infectieuse.
q les événements ont été rapportés à partir des données postérieures à la mise sur le marché.
r inclut thrombose veineuse profonde, embolie, embolie veineuse, thrombose veineuse pelvienne, thrombose veineuse superficielle et thrombose.
s inclut dyspnée et dyspnée d’effort
t inclut pneumopathie inflammatoire et maladie pulmonaire à médiation immunitaire
u inclut douleur abdominale, douleur abdominale basse, douleur abdominale haute et douleur du flanc.
v inclut stomatite et inflammation des muqueuses.
w inclut colite, entérite, entérocolite, entérocolite à médiation immunitaire et proctite
x inclut pancréatite, pancréatite aigüe et pancréatite à médiation immunitaire.
y inclut alanine aminotransférase augmentée, aspartate aminotransférase augmentée, enzymes hépatiques augmentées et transaminases augmentées.
z inclut hépatite, hépatite auto-immune, hépatite toxique, hépatite aiguë, hépatotoxicité, hépatite à médiation immunitaire et cytolyse hépatique.
aa inclut éruption cutanée érythémateuse, éruption cutanée maculeuse, éruption cutanée maculopapuleuse, éruption cutanée papuleuse, éruption cutanée prurigineuse, éruption cutanée pustuleuse, érythème, eczéma et éruption cutanée.
bb inclut dermatite et dermatite à médiation immunitaire.
cc inclut pemphigoïde, dermatite bulleuse et pemphigus. La fréquence rapportée dans les études achevées et en cours est peu fréquent.
dd inclut myosite et rhabdomyolyse.
ee inclut arthrite auto-immune, arthrite à médiation immunitaire, polyarthrite et polyarthrite rhumatoïde.
ff une polymyosite (fatale) a été observée chez un patient traité par IMFINZI dans un essai clinique sponsorisé en cours, en dehors des données poolées.
gg non observé dans le pool IMFINZI + chimiothérapie ou dans les données chimiothérapie à base de platine + IMFINZI + olaparib mais observé dans d’autres études cliniques sponsorisées par AstraZeneca
hh inclut néphrite auto-immune, néphrite tubulo-interstitielle, néphrite, glomérulonéphrite, glomérulonéphrite extramembraneuse et une néphrite à médiation immunitaire.
ii inclut fatigue et asthénie.
jj inclut œdème périphérique et gonflement périphérique.
kk inclut réaction à la perfusion et urticaire débutant le jour du traitement ou 1 jour après
Tableau 4. Effets indésirables chez les patients traités par IMFINZI en association avec le trémélimumab
| IMFINZI en association avec trémélimumab 75 mg et une chimiothérapie à base de platine | IMFINZI en association avec trémélimumab 300 mg | ||
Infections et infestations | ||||
Très fréquent | Infections des voies respiratoires supérieuresa, Pneumonieb |
| ||
Fréquent | Grippe, Candidose orale | Infections des voies respiratoires supérieuresa, Pneumonieb, Grippe, Infections dentaires et des tissus mous buccauxc | ||
Peu fréquent | Infections dentaires et des tissus mous buccauxc | Candidose orale | ||
Affections hématologiques et du système lymphatique | ||||
Très fréquent | Anémied, Neutropénied,e, Thrombopénied,f, Leucopénied,g |
| ||
Fréquent | Neutropénie fébriled, Pancytopénied |
| ||
Peu fréquent | Thrombopénie immunitaire |
| ||
Fréquence indéterminée |
| Thrombopénie immunitaireh | ||
Affections endocriniennes | ||||
Très fréquent | Hypothyroïdiei | Hypothyroïdiei | ||
Fréquent | Hyperthyroïdiej, Insuffisance surrénalienne, Hypopituitarisme/hypophysite, Thyroïditek | Hyperthyroïdiej, Thyroïditek, Insuffisance surrénalienne | ||
Peu fréquent | Diabète insipide, Diabète sucré de type 1 | Hypopituitarisme/hypophysite | ||
Fréquence indéterminée |
| Diabète insipideh, Diabète sucré de type 1h | ||
Affections oculaires | ||||
Peu fréquent | Uvéite |
| ||
Rare |
| Uvéiteh | ||
Affections du métabolisme et de la nutrition | ||||
Très fréquent | Diminution de l’appétitd |
| ||
Affections du système nerveux | ||||
Fréquent | Neuropathie périphériqued,l |
| ||
Peu fréquent | Encephalitem | Myasthénie grave, Méningite | ||
Fréquence indéterminée | Myasthénie graven, Syndrome de Guillain-Barrén, Méningiten, Myélite transverseo | Syndrome de Guillain-Barréh, Encéphaliteh, Myélite transverseo | ||
Affections cardiaques | ||||
Peu fréquent | Myocarditep | Myocardite | ||
Affections respiratoires, thoraciques et médiastinales | ||||
Très fréquent | Toux / toux productive | Toux / toux productive | ||
Fréquent | Pneumopathie inflammatoireq, Dysphonie | Pneumopathie inflammatoireq | ||
Peu fréquent | Pneumopathie interstitielle diffuse | Dysphonie, Pneumopathie interstitielle diffuse | ||
Affections gastro-intestinales | ||||
Très fréquent | Nauséesd, Diarrhées, Constipationd, Vomissementsd | Diarrhées, Douleurs abdominalesr | ||
Fréquent | Stomatited,s, Amylase augmentée, Douleurs abdominalesr, Lipase augmentée, Colitet, Pancréatiteu | Lipase augmentée, Amylase augmentée, Colitet, Pancréatiteu | ||
Rare | Maladie cœliaquen | Maladie cœliaqueh | ||
Fréquence indéterminée | Perforation intestinalen, perforation du gros intestinn | Perforation intestinaleh, perforation du gros intestinh | ||
Affections hépatobiliaires | ||||
Très fréquent | Aspartate aminotransférase augmentée ou Alanine aminotransférase augmentéev | Aspartate aminotransférase augmentée ou Alanine aminotransférase augmentéev | ||
Fréquent | Hépatitew | Hépatitew | ||
Affections de la peau et du tissu sous-cutané | ||||
Très fréquent | Alopécied, Eruption cutanéex, Prurit | Eruption cutanéex, Prurit | ||
Fréquent |
| Dermatitey, Sueurs nocturnes | ||
Peu fréquent | Dermatite, Sueurs nocturnes, Pemphigoïde | Pemphigoïde | ||
Affections musculo-squelettiques et du tissu conjonctif | ||||
Très fréquent | Arthralgie |
| ||
Fréquent | Myalgie | Myalgie | ||
Peu fréquent | Myositez, Polymyositez, Arthrite à médiation immunitairen | Myositez, Polymyositez, Arthrite à médiation immunitaire, Pseudopolyarthrite rhizomélique | ||
Fréquence indéterminée | Pseudopolyarthrite rhizoméliquen |
| ||
Affections du rein et des voies urinaires | ||||
Fréquent | Créatinine sanguine augmentée, Dysurie | Créatinine sanguine augmentée, Dysurie | ||
Peu fréquent | Néphrite, Cystite non infectieuse | Néphriteaa | ||
Fréquence indéterminée |
| Cystite non infectieuseh | ||
Troubles généraux et anomalies au site d’administration | ||||
Très fréquent | Fatigued, Fièvre | Fièvre, Œdème périphériquebb | ||
Fréquent | Œdème périphériquebb |
| ||
Lésions, intoxication et complications liées aux procédures | ||||
Fréquent | Réaction liée à la perfusioncc | Réaction liée à la perfusioncc | ||
a inclut laryngite, nasopharyngite, pharyngite, rhinite, sinusite, angine, trachéobronchite et infection des voies respiratoires supérieures.
b inclut pneumonie à Pneumocystis jirovecii, pneumonie et pneumonie bactérienne.
c inclut parodontite, pulpite dentaire, abcès dentaire et infection dentaire.
d l’effet indésirable ne s’applique qu’à la chimiothérapie dans l’étude POSEIDON.
e inclut neutropénie et diminution du nombre de neutrophiles.
f inclut diminution du nombre de plaquettes et thrombopénie.
g inclut leucopénie et diminution du nombre de globules blancs.
h l’effet indésirable n’a pas été observé dans le pool CHC, mais a été rapporté chez des patients traités par IMFINZI ou IMFINZI+trémélimumab dans des essais cliniques sponsorisés par AstraZeneca.
i inclut augmentation de l'hormone thyréostimulante dans le sang, hypothyroïdie et hypothyroïdie à médiation immunitaire.
j inclut diminution de l'hormone thyréostimulante dans le sang et hyperthyroïdie.
k inclut thyroïdite auto-immune, thyroïdite à médiation immunitaire, thyroïdite et thyroïdite subaiguë.
l inclut neuropathie périphérique, paresthésie et neuropathie périphérique sensitive
m inclut encéphalite et encéphalite auto-immune.
n l’effet indésirable n’a pas été observé dans l’étude POSEIDON, mais a été rapporté chez des patients traités par IMFINZI ou IMFINZI+trémélimumab dans des essais cliniques autres que POSEIDON.
o rapporté dans des études cliniques autres que l’étude POSEIDON et le pool CHC.
p inclut myocardite auto-immune.
q inclut pneumopathie inflammatoire à médiation immunitaire et pneumopathie inflammatoire.
r inclut douleur abdominale, douleur abdominale basse, douleur abdominale haute et douleur du flanc.
s inclut inflammation des muqueuses et stomatite.
t inclut colite, entérite et entérocolite.
u inclut pancréatite auto-immune, pancréatite et pancréatite aigüe.
v inclut alanine aminotransférase augmentée, aspartate aminotransférase augmentée, enzymes hépatiques augmentées et transaminases augmentées.
w inclut hépatite auto-immune, hépatite, lésion hépatocellulaire, hépatotoxicité, hépatite aiguë et hépatite à médiation immunitaire.
x inclut eczéma, érythème, éruption cutanée, éruption cutanée maculeuse, éruption cutanée maculopapuleuse, éruption cutanée papuleuse, éruption cutanée prurigineuse et éruption cutanée pustuleuse.
y inclut dermatite et dermatite à médiation immunitaire.
z inclut rhabdomyolyse, myosite et polymyosite.
aa inclut néphrite auto-immune et néphrite à médiation immunitaire.
bb inclut œdème périphérique et gonflement périphérique.
cc inclut réaction à la perfusion et urticaire.
Description des effets indésirables sélectionnés
IMFINZI est associé à des effets indésirables à médiation immunitaire. La plupart d’entre eux, y compris les effets sévères, se sont résolus après l’initiation d’une thérapie médicale appropriée et/ou de modifications de traitement. Les données correspondant aux effets indésirables à médiation immunitaire suivants reflètent la base de données de tolérance combinées d’IMFINZI en monothérapie chez 4 642 patients dont les études PACIFIC, HIMALAYA et ADRIATIC et des études supplémentaires chez des patients atteints de tumeurs solides diverses, dans des indications pour lesquelles le durvalumab n’est pas autorisé. Dans toutes les études, IMFINZI a été administré à une dose de 10 mg/kg toutes les 2 semaines, 20 mg/kg toutes les 4 semaines ou 1 500 mg toutes les 3 ou 4 semaines. Des détails sur les effets indésirables principaux d’IMFINZI administré en association avec une chimiothérapie sont présentés lorsque des différences cliniquement pertinentes étaient notées comparativement à IMFINZI en monothérapie.
Les données relatives aux effets indésirables à médiation immunitaire suivants sont également basées sur 2 280 patients ayant reçu IMFINZI 20 mg/kg toutes les 4 semaines en association avec le trémélimumab 1 mg/kg ou IMFINZI 1 500 mg en association avec le trémélimumab 75 mg toutes les 4 semaines. Des détails sur les effets indésirables principaux d’IMFINZI administré en association avec le trémélimumab et une chimiothérapie à base de platine sont présentés lorsque des différences cliniquement pertinentes ont été notées comparativement à IMFINZI en association avec le trémélimumab.
Les données relatives aux effets indésirables à médiation immunitaire suivants reflètent également la base de données de tolérance combinée d’IMFINZI en association avec trémélimumab 300 mg de 462 patients atteints d’un CHC (le pool CHC). Dans ces deux études, IMFINZI a été administré à une dose de 1 500 mg en association avec 300 mg de trémélimumab toutes les 4 semaines.
Les recommandations de traitement de ces effets indésirables sont décrites dans les rubriques 4.2 et 4.4.
Pneumopathie à médiation immunitaire
Dans la base de données combinées de tolérance d’IMFINZI en monothérapie (n = 4 642 plusieurs types de tumeurs), une pneumopathie à médiation immunitaire est survenue chez 147 (3.2%) patients, y compris de grade 3 chez 37 (0,8 %) patients, de grade 4 chez 2 (< 0,1 %) patients, et de grade 5 chez 10 (0,2 %) patients. Le temps médian de survenue a été de 56 jours (de 1 à 1 308 jours). Cent quatorze patients sur 147 ont reçu un traitement par corticoïdes à haute dose (au moins 40 mg de prednisone ou équivalent par jour) et 4 patients ont également reçu d'autres immunosuppresseurs, notamment de l’infliximab et de la cyclosporine. IMFINZI a été interrompu chez 60 patients. La résolution a eu lieu chez 85 patients.
Une pneumopathie à médiation immunitaire est survenue plus fréquemment chez les patients de l’étude PACIFIC ayant achevé le traitement par chimioradiothérapie concomitante dans les 1 à 42 jours précédant le début du traitement de l’étude (10,7 %), que chez les autres patients de la base de données combinées de tolérance (1,0 %).
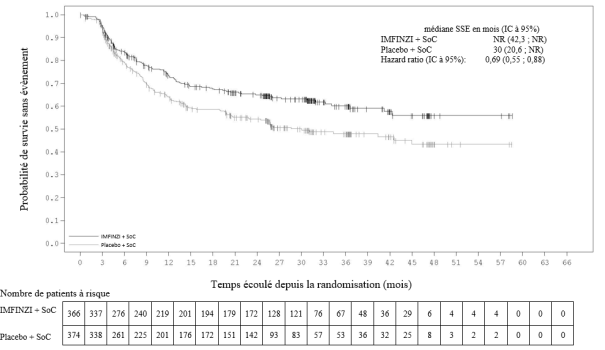
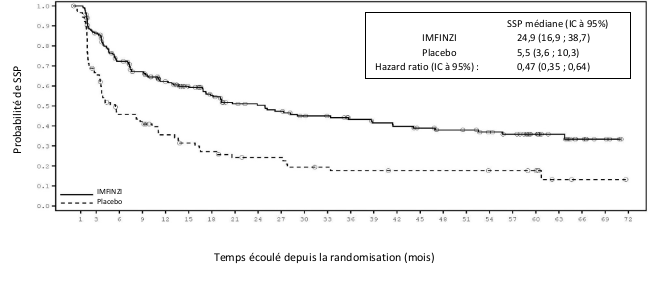
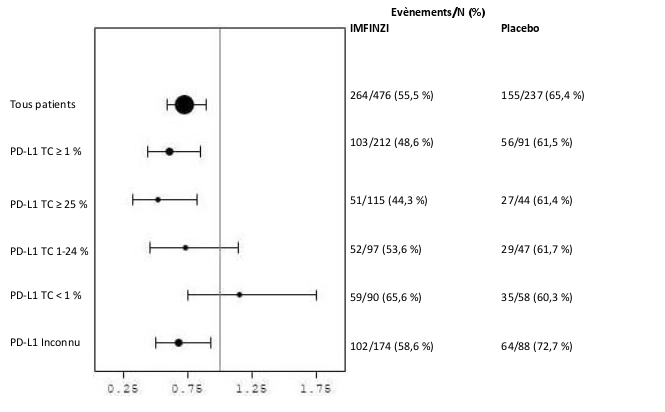
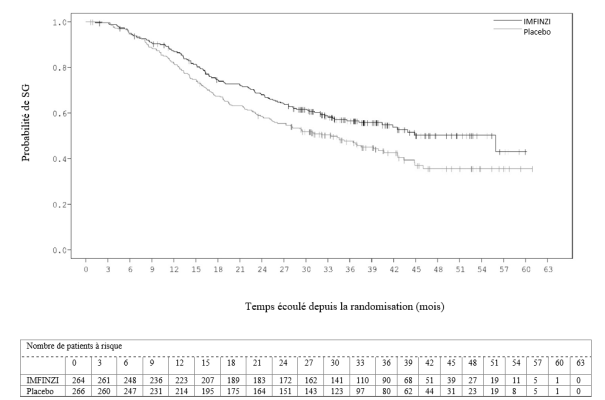
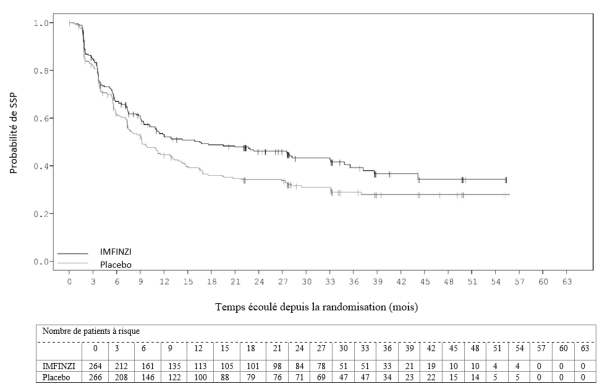
Dans l’étude PACIFIC (n = 475 dans le bras IMFINZI, et n = 234 dans le bras placebo) une pneumopathie à médiation immunitaire est survenue chez 47 (9,9 %) patients dans le groupe traité par IMFINZI et chez 14 (6,0 %) patients du groupe placebo, y compris de grade 3 chez 9 (1,9 %) patients sous IMFINZI vs. 6 (2,6 %) patients sous placebo et de grade 5 (fatal) chez 4 (0,8 %) patients sous IMFINZI vs. 3 (1,3 %) patients sous placebo. Le délai médian de survenue dans le groupe traité par IMFINZI a été de 46 jours (de 2 à 342 jours) vs. 57 jours (de 26 à 253 jours) dans le groupe placebo. Dans le groupe traité par IMFINZI, tous les patients ont reçu un traitement par corticoïdes systémiques, dont 30 patients qui ont reçu un traitement par corticoïdes à haute dose (au moins 40 mg de prednisone ou équivalent par jour), et 2 patients qui ont également reçu de l’infliximab. Dans le groupe placebo, tous les patients ont reçu un traitement par corticoïdes systémiques, dont 12 patients qui ont reçu un traitement par corticoïdes à haute dose et 1 patient a également reçu un traitement par cyclophosphamide et tacrolimus. La résolution est survenue chez 29 patients du groupe traité par IMFINZI vs. 6 dans le groupe placebo.
Dans l'étude ADRIATIC, chez les patients atteints d’un CBPC-SL (n = 262 dans le bras IMFINZI et n = 265 dans le bras placebo), une pneumopathie à médiation immunitaire est survenue chez 31 (11,8 %) patients dans le groupe traité par IMFINZI et 8 (3,0 %) patients dans le groupe placebo, y compris de grade 3 chez 5 (1,9 %) patients sous IMFINZI vs. 1 (0,4 %) patient sous placebo et un évènement de grade 5 (fatal) chez 1 (0,4 %) patient sous IMFINZI. Le délai médian de survenue dans le groupe traité par IMFINZI était de 55 jours (de 1 à 375 jours) vs. 65,5 jours (de 24 à 124 jours) dans le groupe placebo. Dans le groupe traité par IMFINZI, tous les patients ont reçu un traitement par corticoïdes systémiques, dont 25 patients qui ont reçu un traitement par corticoïdes à haute dose (au moins 40 mg de prednisone ou équivalent par jour) et 1 patient a également reçu un traitement par l’infliximab. Dans le groupe placebo, tous les patients ont reçu un traitement par corticostéroïdes systémiques, dont 7 patients qui ont reçu un traitement par corticoïdes à haute dose. La résolution est survenue chez 18 patients du groupe traité par IMFINZI vs. 3 dans le groupe placebo.
Dans la base de données de tolérance combinée avec IMFINZI en association avec le trémélimumab (n=2 280), une pneumopathie inflammatoire à médiation immunitaire est survenue chez 86 (3,8 %) patients, y compris de grade 3 chez 30 (1,3 %) patients, de grade 4 chez 1 (< 0,1 %) patient et de grade 5 (fatal) chez 7 (0,3 %) patients. Le délai médian de survenue a été de 57 jours (de 8 à 912 jours). Tous les patients ont reçu un traitement par corticoïdes systémiques et 79 des 86 patients ont reçu un traitement par corticoïdes à haute dose (au moins 40 mg de prednisone ou équivalent par jour). Sept patients ont reçu d’autres immunosuppresseurs. Le traitement a été arrêté chez 39 patients. La résolution a eu lieu chez 51 patients.
Dans le pool CHC (n=462), une pneumopathie inflammatoire à médiation immunitaire est survenue chez 6 (1,3 %) patients, dont un événement de grade 3 chez 1 (0,2 %) patient et un événement de grade 5 (fatal) chez 1 (0,2 %) patient. Le délai médian de survenue était de 29 jours (de 5 à 774 jours). Six patients ont reçu des corticoïdes systémiques, et 5 patients sur 6 ont reçu un traitement par corticoïdes à haute dose (au moins 40 mg de prednisone ou équivalent par jour). Un patient a également reçu d’autres immunosuppresseurs. Le traitement a été arrêté chez 2 patients. La résolution a eu lieu chez 3 patients.
Dans l'étude DUO-E, sur 238 patients traités par chimiothérapie à base de platine en association avec IMFINZI, suivi par IMFINZI en association avec l'olaparib (bras chimiothérapie à base de platine + IMFINZI + olaparib), une pneumopathie à médiation immunitaire est survenue chez 5 (2,1 %) patients, dont une pneumopathie de grade 3 chez 3 (1,3 %) patients. Le délai médian de survenue a été de 85 jours (de 65 à 321 jours). Cinq patients ont reçu un traitement par corticoïdes systémiques, dont des corticoïdes à haute dose (au moins 40 mg de prednisone ou équivalent par jour) pour 4 patients. La résolution a eu lieu chez les 5 patients.
Hépatite à médiation immunitaire
Dans la base de données combinées de tolérance d’IMFINZI en monothérapie, une hépatite à médiation immunitaire est survenue chez 120 (2,6 %) patients, y compris de grade 3 chez 70 (1,5 %) patients, de grade 4 chez 9 (0,2 %) patients et de grade 5 (fatal) chez 6 (0,1 %) patients. Le délai médian de survenue a été de 36 jours (de 1 à 644 jours). Quatre-vingt-quatorze patients sur 120 ont reçu un traitement par corticoïdes à haute dose (au moins 40 mg de prednisone ou équivalent par jour). Neuf patients ont également reçu un traitement par d'autres immunosuppresseurs, notamment du mycophénolate. IMFINZI a été interrompu chez 30 patients. La résolution est survenue chez 56 patients.
Dans la base de données de tolérance combinée avec IMFINZI en association avec le trémélimumab (n=2280), une hépatite à médiation immunitaire est survenue chez 80 (3,5 %) patients, y compris de grade 3 chez 48 (2,1 %) patients, de grade 4 chez 8 (0,4 %) patients et de grade 5 (fatal) chez 2 (< 0,1 %) patients. Le délai médian de survenue a été de 36 jours (de 1 à 533 jours). Tous les patients ont reçu un traitement par corticoïdes systémiques et 68 des 80 patients ont reçu un traitement par corticoïdes à haute dose (au moins 40 mg de prednisone ou équivalent par jour). Huit patients ont également reçu d’autres immunosuppresseurs. Le traitement a été arrêté chez 27 patients. La résolution a eu lieu chez 47 patients.
Dans le pool CHC (n=462), une hépatite à médiation immunitaire est survenue chez 34 (7,4 %) patients, dont un événement de grade 3 chez 20 (4,3 %) patients, un événement de grade 4 chez 1 (0,2 %) patient et un événement de grade 5 (fatal) chez 3 (0,6 %) patients. Le délai médian de survenue était de 29 jours (de 13 à 313 jours). Tous les patients ont reçu des corticoïdes systémiques, et 32 patients sur 34 ont reçu un traitement par corticoïdes à haute dose (au moins 40 mg de prednisone ou équivalent par jour). Neuf patients ont également reçu d’autres immunosuppresseurs. Le traitement a été arrêté chez 10 patients. La résolution a eu lieu chez 13 patients.
Colite à médiation immunitaire
Dans la base de données combinées de tolérance d’IMFINZI en monothérapie, une colite ou une diarrhée à médiation immunitaire est survenue chez 79 (1,7 %) patients, y compris de grade 3 chez 15 (0,3 %) patients, et de grade 4 chez 2 (< 0,1 %) patients. Le délai médian de survenue a été de 72 jours (de 1 à 920 jours). Cinquante-cinq patients sur 79 ont reçu un traitement par corticoïdes à haute dose (au moins 40 mg de prednisone ou équivalent par jour). Cinq patients ont également reçu un traitement par d'autres immunosuppresseurs, notamment de l’infliximab et du mycophénolate. IMFINZI a été interrompu chez 15 patients. La résolution a eu lieu chez 54 patients.
Dans la base de données de tolérance combinée avec IMFINZI en association avec le trémélimumab (n=2 280), une colite ou une diarrhée à médiation immunitaire est survenue chez 167 (7,3 %) patients, y compris de grade 3 chez 76 (3,3 %) patients et de grade 4 chez 3 (0,1 %) patients. Le délai médian de survenue a été de 57 jours (de 3 à 906 jours). Tous les patients ont reçu un traitement par corticoïdes systémiques et 151 des 167 patients ont reçu un traitement par corticoïdes à haute dose (au moins 40 mg de prednisone ou équivalent par jour). Vingt-deux patients ont également reçu d’autres immunosuppresseurs. Le traitement a été arrêté chez 54 patients. La résolution a eu lieu chez 141 patients.
Des cas de perforation intestinale et de perforation du gros intestin ont été décrits de façon peu fréquente chez des patients recevant IMFINZI en association avec le trémélimumab.
Dans le pool CHC (n=462), une colite ou une diarrhée à médiation immunitaire est survenue chez 31 (6,7 %) patients, dont un événement de grade 3 chez 17 (3,7 %) patients. Le délai médian de survenue était de 23 jours (de : 2 à 479 jours). Tous les patients ont reçu des corticoïdes systémiques, et 28 patients sur 31 ont reçu un traitement par corticoïdes à haute dose (au moins 40 mg de prednisone ou équivalent par jour). Quatre patients ont également reçu d’autres immunosuppresseurs. Le traitement a été arrêté chez 5 patients. La résolution a eu lieu chez 29 patients.
Une perforation intestinale a été observée chez des patients recevant IMFINZI en association avec le trémélimumab (rare) dans des études en dehors du pool CHC.
Endocrinopathies à médiation immunitaire
Hypothyroïdie à médiation immunitaire
Dans la base de données combinées de tolérance d’IMFINZI en monothérapie, une hypothyroïdie à médiation immunitaire est survenue chez 384 (8,3%) patients, y compris de grade 3 chez 7 (0,2 %) patients. Le délai médian de survenue a été de 90,5 jours (de 1 à 951 jours). Parmi les 384 patients, 379 ont reçu un traitement hormonal substitutif et 7 patients ont reçu un traitement par corticoïdes à haute dose (au moins 40 mg de prednisone ou équivalent par jour) pour cause d’hypothyroïdie à médiation immunitaire. Un patient a arrêté de prendre IMFINZI en raison d’une hypothyroïdie à médiation immunitaire. La résolution a eu lieu chez 79 patients.
Dans la base de données de tolérance combinée avec IMFINZI en association avec le trémélimumab (n=2 280), une hypothyroïdie à médiation immunitaire est survenue chez 209 (9,2 %) patients, y compris de grade 3 chez 6 (0,3 %) patients. Le délai médian de survenue a été de 85 jours (de 1 à 624 jours). Treize patients ont reçu un traitement par corticoïdes systémiques et 8 des 13 patients ont reçu un traitement par corticoïdes à haute dose (au moins 40 mg de prednisone ou équivalent par jour). Le traitement a été arrêté chez 3 patients. La résolution a eu lieu chez 52 patients. Une hypothyroïdie à médiation immunitaire a été précédée d’une hyperthyroïdie à médiation immunitaire chez 25 patients ou d’une thyroïdite à médiation immunitaire chez 2 patients.
Dans le pool CHC (n=462), une hypothyroïdie à médiation immunitaire est survenue chez 46 (10,0 %) patients. Le délai médian de survenue était de 85 jours (de 26 à 763 jours). Un patient a reçu un traitement par corticoïdes à haute dose (au moins 40 mg de prednisone ou équivalent par jour). Tous les patients ont eu besoin d’un autre traitement, notamment une hormonothérapie substitutive. La résolution a eu lieu chez 6 patients. L’hypothyroïdie à médiation immunitaire était précédée d’une hyperthyroïdie à médiation immunitaire chez 4 patients.
Hyperthyroïdie à médiation immunitaire
Dans la base de données combinées de tolérance d’IMFINZI en monothérapie, une hyperthyroïdie à médiation immunitaire est survenue chez 76 (1,6 %) patients. Le délai médian de survenue a été de 43 jours (de 1 à 253 jours). Soixante et onze des 76 patients, ont reçu un traitement médicamenteux (thiamazole, carbimazole, propylthiouracile, perchlorate, inhibiteur calcique ou bêtabloquant), 15 patients ont reçu un traitement par corticoïdes systémiques et 8 de ces 15 patients ont reçu un traitement par corticoïdes à haute dose (au moins 40 mg de prednisone ou équivalent par jour). Un patient a arrêté IMFINZI en raison d’une hyperthyroïdie à médiation immunitaire. La résolution est survenue chez 62 patients. Trente et un patients ont présenté une hypothyroïdie à la suite d’une hyperthyroïdie.
Dans la base de données de tolérance combinée avec IMFINZI en association avec le trémélimumab (n=2 280), une hyperthyroïdie à médiation immunitaire est survenue chez 62 (2,7 %) patients, y compris de grade 3 chez 5 (0,2 %) patients. Le délai médian de survenue a été de 33 jours (de 4 à 176 jours). Dix-huit patients ont reçu un traitement par corticoïdes systémiques et 11 des 18 patients ont reçu un traitement par corticoïdes à haute dose (au moins 40 mg de prednisone ou équivalent par jour). Cinquante-trois patients ont eu besoin d’un autre traitement (thiamazole, carbimazole, propylthiouracile, perchlorate de sodium, les inhibiteurs calciques ou bêtabloquants). Un patient a arrêté le traitement en raison d’une hyperthyroïdie. La résolution a eu lieu chez 47 patients.
Dans le pool CHC (n=462), une hyperthyroïdie à médiation immunitaire est survenue chez 21 (4,5 %) patients, dont un événement de grade 3 chez 1 (0,2 %) patient. Le délai médian de survenue était de 30 jours (de 13 à 60 jours). Quatre patients ont reçu des corticoïdes systémiques, et les quatre patients ont reçu un traitement par corticoïdes à haute dose (au moins 40 mg de prednisone ou équivalent par jour). Vingt patients ont eu besoin d’un autre traitement (thiamazole, carbimazole, propylthiouracile, perchlorate, inhibiteur calcique ou bêta-bloquant). Un patient a arrêté le traitement en raison d’une hyperthyroïdie. La résolution a eu lieu chez 17 patients.
Thyroïdite à médiation immunitaire
Dans la base de données combinées de tolérance d’IMFINZI en monothérapie, une thyroïdite à médiation immunitaire est survenue chez 21 (0,5 %) patients, y compris de grade 3 chez 2 (< 0,1 %) patients. Le délai médian de survenue a été de 57 jours (de 14 à 217 jours). Sur les 21 patients, 18 ont reçu un traitement hormonal substitutif et 3 patients ont reçu des corticoïdes à haute dose (au moins 40 mg de prednisone ou équivalent par jour). Un patient a arrêté de prendre IMFINZI en raison d’une thyroïdite à médiation immunitaire. La résolution a eu lieu chez 8 patients. Cinq patients ont présenté une hypothyroïdie après la thyroïdite.
Dans la base de données de tolérance combinée avec IMFINZI en association avec le trémélimumab (n=2 280), une thyroïdite à médiation immunitaire est survenue chez 15 (0,7 %) patients, y compris de grade 3 chez 1 (< 0,1 %) patient. Le délai médian de survenue a été de 57 jours (de 22 à 141 jours). Cinq patients ont reçu un traitement par corticoïdes systémiques et 2 des 5 patients ont reçu un traitement par corticoïdes à haute dose (au moins 40 mg de prednisone ou équivalent par jour). Treize patients ont eu besoin d’un autre traitement, pouvant inclure la thérapie hormonale substitutive, le thiamazole, carbimazole, propylthiouracile, perchlorate de sodium, les inhibiteurs calciques ou bêtabloquants. Aucun patient n’a arrêté le traitement en raison d’une thyroïdite à médiation immunitaire. La résolution a eu lieu chez 5 patients.
Dans le pool CHC (n=462), une thyroïdite à médiation immunitaire est survenue chez 6 (1,3 %) patients. Le délai médian de survenue était de 56 jours (de 7 à 84 jours). Deux patients ont reçu des corticoïdes systémiques, et 1 patient sur 2 a reçu un traitement par corticoïdes à haute dose (au moins 40 mg de prednisone ou équivalent par jour). Tous les patients ont eu besoin d’un autre traitement, notamment une hormonothérapie substitutive. La résolution a eu lieu chez 2 patients.
Insuffisance surrénalienne à médiation immunitaire
Dans la base de données combinées de tolérance d’IMFINZI en monothérapie, une insuffisance surrénalienne à médiation immunitaire est survenue chez 24 (0,5 %) patients, y compris de grade 3 chez 8 (0,2 %) patients. Le délai médian de survenue a été de 157,5 jours (de 20 à 547 jours). Les 24 patients ont tous reçu un traitement par corticoïdes systémiques, 8 d’entre eux ont reçu un traitement par corticoïdes à haute dose (au moins 40 mg de prednisone ou équivalent par jour). Un patient a arrêté de prendre IMFINZI en raison d’une insuffisance surrénalienne à médiation immunitaire. La résolution a eu lieu chez 6 patients.
Dans la base de données de tolérance combinée avec IMFINZI en association avec le trémélimumab, une insuffisance surrénalienne à médiation immunitaire est survenue chez 33 (1,4 %) patients, y compris de grade 3 chez 16 (0,7 %) patients et de grade 4 chez 1 (< 0,1 %) patient. Le délai médian de survenue a été de 105 jours (de 20 à 428 jours). Trente-deux patients ont reçu un traitement par corticoïdes systémiques et 10 des 32 patients ont reçu un traitement par corticoïdes à haute dose (au moins 40 mg de prednisone ou équivalent par jour). Le traitement a été arrêté chez un patient. La résolution a eu lieu chez 11 patients.
Dans le pool CHC (n=462), une insuffisance surrénalienne à médiation immunitaire est survenue chez 6 (1,3 %) patients, dont un événement de grade 3 chez 1 (0,2 %) patient. Le délai médian de survenue était de 64 jours (de 43 à 504 jours). Tous les patients ont reçu des corticoïdes systémiques, et 1 patient sur 6 a reçu un traitement par corticoïdes à haute dose (au moins 40 mg de prednisone ou équivalent par jour). La résolution a eu lieu chez 2 patients.
Diabète sucré de type 1 à médiation immunitaire
Dans la base de données combinées de tolérance d’IMFINZI en monothérapie, un diabète sucré de type 1 à médiation immunitaire est survenu chez 5 (0,1 %) patients, y compris de grade 3 chez 3 (0,1 %) patients et de grade 4 chez 1 (< 0,1 %) patient. Le délai de survenue a été de 43 jours (de 29 à 631 jours). Les cinq patients ont nécessité une insulinothérapie. Le traitement par IMFINZI a été arrêté définitivement chez un patient. Un patient s'est rétabli et un patient s’est rétabli avec des séquelles.
Dans la base de données de tolérance combinée avec IMFINZI en association avec le trémélimumab, (n=2 280), un diabète sucré de type 1 à médiation immunitaire est survenu chez 6 (0,3 %) patients, y compris de grade 3 chez 1 (< 0,1 %) patient et de grade 4 chez 2 (< 0,1 %) patients. Le délai médian de survenue a été de 58 jours (de 7 à 220 jours). Tous les patients ont eu besoin d’insuline. Le traitement a été arrêté chez 1 patient. La résolution a eu lieu chez 1 patient.
Hypophysite/hypopituitarisme à médiation immunitaire
Dans la base de données combinées de tolérance d’IMFINZI en monothérapie, une hypophysite / un hypopituitarisme à médiation immunitaire est survenu(e) chez 6 (0,1 %) patients, y compris de grade 3 chez 5 (0,1 %) patients. Le délai médian de survenue des événements était respectivement de 85 jours (de 44 à 225 jours). Trois patients ont reçu un traitement par corticoïdes à haute dose (au moins 40 mg de prednisone ou équivalent par jour), trois patients ont interrompu le traitement par IMFINZI en raison de l’hypophysite / hypopituitarisme à médiation immunitaire et la résolution a eu lieu chez 1 patient.
Dans la base de données de tolérance combinée avec IMFINZI en association avec le trémélimumab (n=2 280), une hypophysite/un hypopituitarisme à médiation immunitaire est survenu(e) chez 16 (0,7 %) patients, y compris de grade 3 chez 8 (0,4 %) patients. Le délai médian de survenue des événements a été de 123 jours (de 63 à 388 jours). Tous les patients ont reçu un traitement par corticoïdes systémiques et 8 des 16 patients ont reçu un traitement par corticoïdes à haute dose (au moins 40 mg de prednisone ou équivalent par jour). Quatre patients ont eu besoin d’une thérapie endocrinienne. Le traitement a été arrêté chez 2 patients. La résolution a eu lieu chez 7 patients.
Dans le pool CHC (n=462), une hypophysite/un hypopituitarisme à médiation immunitaire est survenu(e) chez 5 (1,1 %) patients. Le délai médian de survenue de ces événements était de 149 jours (de 27 à 242 jours). Quatre patients ont reçu des corticoïdes systémiques, et 1 patient sur 4 a reçu un traitement par corticoïdes à haute dose (au moins 40 mg de prednisone ou équivalent par jour). Trois patients ont également eu besoin d’une thérapie endocrinienne. La résolution a eu lieu chez 2 patients.
Néphrite à médiation immunitaire
Dans la base de données combinées de tolérance d’IMFINZI en monothérapie, une néphrite à médiation immunitaire est survenue chez 17 (0,4 %) patients, y compris de grade 3 chez 4 (0,1 %) patients et de grade 4 chez 1 (< 0,1 %) patient. Le délai médian de survenue a été de 84 jours (de 4 à 393 jours). Douze patients ont reçu un traitement par corticoïdes à haute dose (au moins 40 mg de prednisone ou équivalent par jour) et 1 patient a également reçu du mycophénolate. Le traitement par IMFINZI a été interrompu chez 7 patients. La résolution a eu lieu chez 8 patients.
Dans la base de données de tolérance combinée avec IMFINZI en association avec le trémélimumab (n=2 280), une néphrite à médiation immunitaire est survenue chez 9 (0,4 %) patients, y compris de grade 3 chez 1 (< 0,1 %) patient. Le délai médian de survenue a été de 79 jours (de 39 à 183 jours). Tous les patients ont reçu un traitement par corticoïdes systémiques et 7 patients ont reçu un traitement par corticoïdes à haute dose (au moins 40 mg de prednisone ou équivalent par jour). Le traitement a été arrêté chez 3 patients. La résolution a eu lieu chez 5 patients.
Dans le pool CHC (n=462), une néphrite à médiation immunitaire est survenue chez 4 (0,9 %) patients, dont un événement de grade 3 chez 2 (0,4 %) patients. Le délai médian de survenue était de 53 jours (de 26 à 242 jours). Tous les patients ont reçu des corticoïdes systémiques, et 3 patients sur 4 ont reçu un traitement par corticoïdes à haute dose (au moins 40 mg de prednisone ou équivalent par jour). Le traitement a été arrêté chez 2 patients. La résolution a eu lieu chez 3 patients.
Eruption cutanée à médiation immunitaire
Dans la base de données combinées de tolérance d’IMFINZI en monothérapie, une éruption cutanée ou une dermatite à médiation immunitaire (y compris une pemphigoïde) est survenue chez 74 (1,6 %) patients, y compris de grade 3 chez 20 (0,4 %) patients. Le délai médian de survenue a été de 56 jours (de 4 à 600 jours). Trente-sept patients sur 74 ont reçu un traitement par corticoïdes à haute dose (au moins 40 mg de prednisone ou équivalent par jour). Le traitement par IMFINZI a été interrompu chez 5 patients. La résolution a eu lieu chez 46 patients.
Dans la base de données de tolérance combinée avec IMFINZI en association avec le trémélimumab (n=2 280), une éruption cutanée ou une dermatite (y compris une pemphigoïde) à médiation immunitaire est survenu(e) chez 112 (4,9 %) patients, y compris de grade 3 chez 17 (0,7 %) patients. Le délai médian de survenue a été de 35 jours (de 1 à 778 jours). Tous les patients ont reçu un traitement par corticoïdes systémiques et 57 des 112 patients ont reçu un traitement par corticoïdes à haute dose (au moins 40 mg de prednisone ou équivalent par jour). Le traitement a été arrêté chez 10 patients. La résolution a eu lieu chez 65 patients.
Dans le pool CHC (n=462), une éruption cutanée ou une dermatite (y compris une pemphigoïde) à médiation immunitaire est survenu(e) chez 26 (5,6 %) patients, dont un événement de grade 3 chez 9 (1,9 %) patients et un événement de grade 4 chez 1 (0,2 %) patient. Le délai médian de survenue était de 25 jours (de 2 à 933 jours). Tous les patients ont reçu des corticoïdes systémiques, et 14 patients sur 26 ont reçu un traitement par corticoïdes à haute dose (au moins 40 mg de prednisone ou équivalent par jour). Un patient a reçu d’autres immunosuppresseurs. Le traitement a été arrêté chez 3 patients. La résolution a eu lieu chez 19 patients.
Dans l'étude DUO-E, sur 238 patients traités par chimiothérapie à base de platine en association avec IMFINZI, suivis par IMFINZI en association avec l'olaparib (bras chimiothérapie à base de platine + IMFINZI + olaparib), une éruption cutanée à médiation immunitaire est survenue chez 8 (3,4 %) patients, dont un événement de grade 3 chez 2 (0,8 %) patients. Le délai médian de survenue était de 155 jours (de 2 à 308 jours). Tous les patients ont reçu un traitement par corticoïde à haute dose (au moins 40 mg de prednisone ou équivalent par jour). La résolution a eu lieu chez les 8 patients.
Réactions liées à la perfusion
Dans la base de données combinées de tolérance sur IMFINZI en monothérapie, les réactions liées à la perfusion sont survenues chez 70 (1,5 %) patients, y compris de grade 3 chez 6 (0,1 %) patients. Aucun événement de grade 4 ou 5 n’est survenu.
Dans la base de données de tolérance combinée avec IMFINZI en association avec le trémélimumab (n=2 280), des réactions liées à la perfusion sont survenues chez 45 (2,0 %) patients, y compris de grade 3 chez 2 (< 0,1 %) patients. Aucun événement de grade 4 ou 5 n’a été observé.
Dans l'étude DUO-E, sur 238 patients traités par chimiothérapie à base de platine en association avec IMFINZI, suivis par IMFINZI en association avec l'olaparib (bras chimiothérapie à base de platine + IMFINZI + olaparib), des réactions liées à la perfusion sont survenues chez 13 (5,5 %) patients, dont une réaction de grade 3 chez 1 (0,4 %) patiente. Aucun événement de grade 4 ou 5 n’a été observé.
Aplasie pure des globules rouges
Une aplasie pure des globules rouges (érythroblastopénie) a été rapportée lorsque IMFINZI a été utilisé en association avec l’olaparib. Dans une étude clinique menée auprès de patientes atteintes d'un cancer de l'endomètre traitées par IMFINZI en association avec l’olaparib, l'incidence d’érythroblastopénie était de 1,6 %. Tous les événements étaient de grade CTCAE 3 ou 4. Les événements étaient gérables après l'arrêt de IMFINZI et de l’olaparib. La majorité des événements ont été pris en charge par transfusion sanguine et traitement immunosuppresseur et sont résolus ; il n'y a pas eu d’événement d’issue fatale. Concernant la prise en charge, voir la rubrique 4.4.
Anomalies du bilan biologique
Chez les patients traités par IMFINZI en monothérapie, la proportion de patients qui ont présenté une évolution de la valeur basale vers une anomalie du bilan biologique de grade 3 ou 4 était de : 3,7 % pour l’alanine aminotransférase augmentée, 5,7 % pour l’aspartate aminotransférase augmentée, 0,9 % pour la créatinine augmentée, 4,8 % pour l’amylase augmentée et 8,2 % pour la lipase augmentée. La proportion de patients ayant présenté une évolution de la valeur de TSH d’une valeur basale ≤ LSN vers une valeur > LSN de tout grade était de 20 % et la proportion de patients ayant présenté une évolution de la valeur de TSH d’une valeur basale ≥ LIN vers une valeur < LIN de tout grade était de 18,2 %.
Chez les patients traités par IMFINZI en association avec une chimiothérapie, la proportion de patients qui ont présenté un déplacement de la valeur basale vers une anomalie du bilan biologique de grade 3 ou 4 était de : 4,6 % pour l’alanine aminotransférase augmentée, 3,9 % pour l’aspartate aminotransférase augmentée, 4,6 % pour la créatinine augmentée, 5,7 % pour l’amylase augmentée, 10,2 % pour la lipase augmentée et 3,0 % pour la bilirubine augmentée. La proportion de patients ayant présenté une évolution de la valeur de TSH d’une valeur basale ≤ LSN vers une valeur > LSN de tout grade était de 23,1 % et la proportion de patients ayant présenté une évolution de la valeur de TSH d’une valeur basale ≥ LIN vers une valeur < LIN de tout grade était de 21,6 %.
Chez les patients traités par IMFINZI en association avec le trémélimumab et une chimiothérapie à base de platine, la proportion de patients qui ont présenté une évolution de la valeur basale vers une anomalie du bilan biologique de grade 3 ou 4 était de : 6,2 % pour l’alanine aminotransférase augmentée, 5,2 % pour l’aspartate aminotransférase augmentée, 4,0 % pour la créatinine sanguine augmentée, 9,4 % pour l’amylase augmentée et 13,6 % pour la lipase augmentée. La proportion de patients ayant présenté une évolution de la valeur de TSH d’une valeur basale ≤ LSN vers une valeur > LSN était de 24,8 % et la proportion de patients ayant présenté une évolution de la valeur de TSH d’une valeur basale ≥ LIN vers une valeur < LIN était de 32,9 %.
Chez les patients traités par IMFINZI en association avec le trémélimumab, la proportion de patients qui ont présenté une évolution de la valeur basale vers une anomalie du bilan biologique de grade 3 ou 4 était de : 5,1 % pour l’alanine aminotransférase augmentée, 5,8 % pour l’aspartate aminotransférase augmentée, 1,0 % pour la créatinine sanguine augmentée, 5,9 % pour l’amylase augmentée et 11,3 % pour la lipase augmentée. La proportion de patients ayant présenté une évolution de la valeur de TSH d’une valeur basale ≤ LSN vers une valeur > LSN était de 4,2 % et la proportion de patients ayant présenté une évolution de la valeur de TSH d’une valeur basale ≥ LIN vers une valeur < LIN était de 17,2 %.
Chez les patients traités par chimiothérapie à base de platine en association avec IMFINZI, suivi par IMFINZI en association avec l'olaparib (bras chimiothérapie à base de platine + IMFINZI + olaparib), la proportion de patients dont les anomalies biologiques sont passées de la valeur initiale à une anomalie biologique de grade 3 ou 4 est la suivante : 3,8 % pour l'alanine aminotransférase augmentée, 3,4 % pour l'aspartate aminotransférase augmentée et 1,7 % pour la créatinine sanguine augmentée. La proportion de patients ayant présenté une modification de la TSH par rapport à la valeur initiale ≤ LSN vers une valeur > LSN était de 28,6 % et une modification de la TSH par rapport à la valeur initiale ≥ LLN vers une valeur < LLN était de 20,1 %.
Immunogénicité
L’immunogénicité d’IMFINZI en monothérapie repose sur les données poolées obtenues chez 3 069 patients traités par IMFINZI 10 mg/kg toutes les 2 semaines ou 20 mg/kg toutes les 4 semaines en monothérapie et chez qui la présence d’anticorps anti-médicament (anti-drug antibodies ou ADA) était évaluable. Quatre-vingt-quatre (2,7 %) ont eu un résultat positif au test des ADA apparus sous traitement. Les anticorps neutralisants (neutralizing antibodies ou nAb) dirigés contre le durvalumab ont été détectés chez 0,5 % (16/3 069) des patients. La présence des ADA n’a pas eu d’effet cliniquement pertinent sur la pharmacocinétique ou la sécurité. Le nombre de patients est insuffisant pour déterminer l’impact des ADA sur l’efficacité.
Dans le cadre de plusieurs études de phase III, chez les patients traités par IMFINZI en association avec d’autres agents thérapeutiques, 0 % à 10,1 % des patients ont développé des ADA apparus sous traitement. Des anticorps neutralisants contre le durvalumab ont été détectés chez 0 % à 1,7 % des patients traités par IMFINZI en association avec d’autres agents thérapeutiques. La présence d'ADA n'a pas eu d'effet apparent sur la pharmacocinétique ou la sécurité.
Sujet âgé
Aucune différence globale de sécurité n'a été rapportée entre les patients âgés (≥ 65 ans) et les patients plus jeunes.
Dans les études PACIFIC, ADRIATIC, CASPIAN, TOPAZ-1, HIMALAYA et NIAGARA, les données sur la sécurité des patients âgés de 75 ans et plus sont trop limitées pour tirer une conclusion sur cette population.
Chez les patients traités en première ligne pour un CBNPC métastatique dans l'étude POSEIDON, des différences de tolérance ont été rapportées entre les patients âgés (≥ 65 ans) et les patients plus jeunes. Les données de sécurité des patients âgés de 75 ans ou plus sont limitées à un total de 74 patients. Il a été observé une fréquence plus élevée d'effets indésirables graves et un taux d'interruption de tout traitement de l'étude en raison d'effets indésirables chez 35 patients âgés de 75 ans ou plus traités par IMFINZI en association avec le trémélimumab et une chimiothérapie à base de platine (45,7 % et 28,6 %, respectivement) par rapport aux 39 patients âgés de 75 ans ou plus ayant reçu uniquement une chimiothérapie à base de platine (35,9 % et 20,5 %, respectivement).
Chez les patients atteints d'un CBNPC résécable dans l'étude AEGEAN, des différences de tolérance ont été rapportées entre les patients âgés (≥ 65 ans) et les patients plus jeunes. Les données de sécurité des patients âgés de 75 ans ou plus sont limitées à 86 patients dans les deux bras de traitement. Il a été observé une fréquence plus élevée d’effets indésirables graves chez les patients âgés de 75 ans ou plus ayant reçu IMFINZI en association avec une chimiothérapie par rapport aux patients ayant reçu une chimiothérapie seule (26,5 % versus 10,8 %, respectivement). Il a été observé une fréquence plus élevée d'arrêts de tout traitement à l'étude en raison d'effets indésirables chez les patients âgés de 75 ans ou plus ayant reçu IMFINZI en association avec une chimiothérapie par rapport aux patients ayant reçu uniquement une chimiothérapie (16,3 % versus 8,1 %, respectivement).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via :
Belgique
Agence fédérale des médicaments et des produits de santé
www.afmps.be
Division Vigilance :
Site internet : www.notifieruneffetindesirable.be
e-mail : adr@fagg-afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy ou Division de la pharmacie et des médicaments de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHÉ
AstraZeneca AB
SE-151 85 Södertälje
Suède
8. NUMÉRO(S) D’AUTORISATION DE MISE SUR LE MARCHÉ
EU/1/18/1322/002 : flacon de 120 mg
EU/1/18/1322/001 : flacon de 500 mg
10. DATE DE MISE À JOUR DU TEXTE
07/2025
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments https://www.ema.europa.eu.
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 3687514 | IMFINZI 120MG SOL PERF IV VIAL 1 120MG/2,4ML | L01FF03 | - | € 597,05 | Oui | - | - |
| 3687522 | IMFINZI 500MG SOL PERF IV VIAL 1 500MG/10ML | L01FF03 | - | € 2487,69 | Oui | - | - |