RESUME DES CARACTERISTIQUES DU PRODUIT
1. DÉNOMINATION DU MÉDICAMENT
Nucala 100 mg, poudre pour solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque flacon contient 100 mg de mépolizumab. Après reconstitution, chaque mL de solution contient 100 mg de mépolizumab.
Le mépolizumab est un anticorps monoclonal humanisé produit par la technologie de l'ADN recombinant dans des cellules ovariennes de hamsters chinois.
Excipients à effet notoire
Chaque dose de 1 mL (après reconstitution) contient 0,74 mg de polysorbate 80.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Poudre pour solution injectable
Poudre blanche lyophilisée.
4. DONNÉES CLINIQUES
4.1 Indications thérapeutiques
Asthme sévère à éosinophiles
Nucala est indiqué chez l'adulte, l’adolescent et l’enfant âgé de 6 ans et plus, en traitement additionnel, dans l’asthme sévère réfractaire à éosinophiles (voir rubrique 5.1).
Polypose naso-sinusienne
Nucala est indiqué en traitement additionnel aux corticostéroïdes par voie nasale chez les patients adultes présentant une polypose naso-sinusienne sévère insuffisamment contrôlés par des corticostéroïdes systémiques et/ou la chirurgie.
Bronchopneumopathie Chronique Obstructive (BPCO)
Nucala est indiqué chez les adultes en traitement de fond additionnel de la bronchopneumopathie chronique obstructive (BPCO) caractérisée par un taux élevé d’éosinophiles sanguins, non contrôlée par l’association corticostéroïdes inhalés (CSI), béta-2-agoniste à longue durée d’action (LABA) et antagoniste muscarinique de longue durée d’action (LAMA) (voir rubrique 5.1).
Granulomatose éosinophilique avec polyangéite
Nucala est indiqué chez les patients âgés de 6 ans et plus, en traitement additionnel des formes récidivantes ou réfractaires de la granulomatose éosinophilique avec polyangéite.
Syndrome hyperéosinophilique
Nucala est indiqué, en traitement additionnel, chez les patients adultes qui présentent un syndrome hyperéosinophilique insuffisamment contrôlé et sans cause secondaire non hématologique identifiable (voir rubrique 5.1).
4.2 Posologie et mode d'administration
Il est recommandé que Nucala soit prescrit par des médecins expérimentés dans le diagnostic et la prise en charge de l’asthme sévère réfractaire à éosinophiles ou de la polypose naso-sinusienne ou de la BPCO ou de la granulomatose éosinophilique polyangéite ou du syndrome hyperéosinophilique.
Posologie
Asthme sévère à éosinophiles
Adultes et adolescents âgés de 12 ans et plus
La dose recommandée de mépolizumab est de 100 mg administrés par voie sous-cutanée une fois toutes les 4 semaines.
Enfants âgés de 6 ans à 11 ans
La dose recommandée de mépolizumab est de 40 mg administrés par voie sous-cutanée une fois toutes les 4 semaines.
Nucala est destiné à un traitement au long cours. La nécessité de poursuivre le traitement est à réévaluer par le médecin au minimum une fois par an, selon un rythme déterminé en fonction de la gravité de la maladie du patient et du niveau de contrôle des exacerbations.
Polypose naso-sinusienne
Adultes
La dose recommandée de mépolizumab est de 100 mg administrés par voie sous-cutanée une fois toutes les 4 semaines.
Nucala est destiné à un traitement au long cours. Des traitements alternatifs peuvent être envisagés chez les patients chez qui aucune réponse au traitement n’est observé après 24 semaines de traitement. Certains patients présentant initialement une réponse partielle peuvent bénéficier d’une amélioration en poursuivant le traitement après 24 semaines.
Bronchopneumopathie chronique obstructive
Adultes
La dose recommandée de mépolizumab est de 100 mg administrés par voie sous-cutanée une fois toutes les 4 semaines.
Nucala est destiné à un traitement au long cours. La nécessité de poursuivre le traitement est à réévaluer par le médecin au minimum une fois par an, selon un rythme déterminé en fonction de la gravité de la maladie et du niveau de contrôle des exacerbations.
Granulomatose éosinophilique avec polyangéite
Adultes et adolescents âgés de 12 ans et plus
La dose recommandée de mépolizumab est de 300 mg administrés par voie sous-cutanée une fois toutes les 4 semaines.
La posologie de mépolizumab chez les enfants et les adolescents âgés de 6 à 17 ans atteints de granulomatose éosinophilique avec polyangéite a été déterminée par des modélisations et des données issues de simulation (voir rubrique 5.2).
Enfants âgés de 6 à 11 ans pesant ≥ 40 kg
La dose recommandée de mépolizumab est de 200 mg, administrés par voie sous-cutanée une fois toutes les 4 semaines.
Enfants âgés de 6 à 11 ans pesant < 40 kg
La dose recommandée de mépolizumab est de 100 mg, administrés par voie sous-cutanée une fois toutes les 4 semaines.
Nucala est destiné à un traitement au long cours. La nécessité de poursuivre le traitement est à réévaluer par le médecin au minimum une fois par an, selon un rythme déterminé en fonction de la gravité de la maladie et de l’amélioration du contrôle des symptômes.
La nécessité de poursuivre le traitement doit également être évaluée chez les patients qui développent des manifestations de granulomatose éosinophilique avec polyangéite menaçant le pronostic vital, compte tenu du fait que Nucala n’a pas été étudié dans cette population.
Syndrome hyperéosinophilique
Adultes
La dose recommandée de mépolizumab est de 300 mg administrés par voie sous-cutanée une fois toutes les 4 semaines.
Nucala est destiné à un traitement au long cours. La nécessité de poursuivre le traitement est à réévaluer par le médecin au minimum une fois par an, selon un rythme déterminé en fonction de la gravité de la maladie du patient et du niveau de contrôle des symptômes.
La nécessité de poursuivre le traitement doit également être évaluée chez les patients qui développent des manifestations de syndrome hyperéosinophilique menaçant le pronostic vital, compte tenu du fait que Nucala n’a pas été étudié dans cette population.
Populations spécifiques
Sujets âgés
Aucune adaptation posologique n'est nécessaire chez les personnes âgées ≥65 ans (voir rubrique 5.2).
Insuffisance rénale et hépatique
Aucune adaptation posologique n’est nécessaire chez les patients présentant une insuffisance rénale ou hépatique (voir rubrique 5.2).
Population pédiatrique
Asthme sévère à éosinophiles
Enfants âgés de moins de 6 ans
La sécurité et l’efficacité du mépolizumab chez les enfants âgés de moins de 6 ans n’ont pas encore été établies.
Aucune donnée n’est disponible.
Enfants âgés de 6 à 17 ans
La posologie du mépolizumab chez l’enfant et l’adolescent (âgés de 6 ans à 17 ans) présentant un asthme sévère réfractaire à éosinophiles a été déterminée sur la base de données limitées issues d’études d’efficacité, de pharmacocinétique et de pharmacodynamie ainsi que de résultats obtenus à partir de modélisation et de simulation (voir rubriques 5.1 et 5.2).
Polypose naso-sinusienne chez les enfants âgés de moins de 18 ans
La sécurité et l'efficacité du mépolizumab chez les enfants âgés de moins de 18 ans présentant une polypose naso-sinusienne n’ont pas été établies. Aucune donnée n'est disponible.
Bronchopneumopathie chronique obstructive chez les enfants âgés de moins de 18 ans
L’utilisation du mépolizumab n’est pas pertinente dans la population pédiatrique (en dessous de 18 ans) pour l’indication dans la BPCO.
Granulomatose éosinophilique avec polyangéite chez les enfants âgés de moins de 6 ans
La sécurité et l’efficacité de mépolizumab n’ont pas été établies chez les enfants de moins de 6 ans.
Aucune donnée n’est disponible.
Syndrome hyperéosinophilique chez les enfants âgés de moins de 18 ans
La sécurité et l’efficacité du mépolizumab chez les enfants et les adolescents âgés de moins de 18 ans n’ont pas encore été établis.
Les données disponibles actuellement sont décrites en rubriques 4.8, 5.1 et 5.2 mais aucune recommandation de posologie ne peut être faite.
Mode d'administration
Nucala doit être administré exclusivement par injection sous-cutanée par un professionnel de santé. L’injection peut se faire, soit dans la partie supérieure du bras, soit au niveau de la cuisse ou de l’abdomen.
Dans le cas d’une dose nécessitant plus d’une injection, il est recommandé que les injections soient espacées d’au moins 5 cm.
Avant administration, la solution injectable sera reconstituée à partir de la poudre. La solution reconstituée doit être utilisée immédiatement. Voir rubrique 6.6 pour les instructions concernant la reconstitution du médicament avant administration.
Chaque flacon de mépolizumab doit être destiné à un patient unique, et toute solution non utilisée doit être jetée.
4.3 Contre-indications
Hypersensibilité à la substance active ou à l'un des excipients mentionnés à la rubrique 6.1.
4.8 Effets indésirables
Résumé du profil de tolérance
Asthme sévère à éosinophiles
Lors des études contrôlées contre placebo menées chez des patients adultes et adolescents atteints d'asthme sévère réfractaire à éosinophiles, les effets indésirables les plus fréquemment rapportés au cours du traitement ont été : céphalées (20%), réactions au site d'injection (8%) et dorsalgies (6%).
Polypose naso-sinusienne
Lors d’une étude contrôlée contre placebo menée chez des patients atteints de polypose naso-sinusienne, les effets indésirables les plus fréquemment rapportés au cours du traitement ont été : céphalées (18%) et dorsalgies (7%).
Bronchopneumopathie chronique obstructive
Dans trois études contrôlées contre placebo menées chez des patients présentant une BPCO, les effets indésirables les plus fréquemment rapportés pendant le traitement étaient les maux de tête (10 %), les dorsalgies (7 %) et les arthralgies (5 %).
Granulomatose éosinophilique avec polyangéite
Lors d’une étude contrôlée contre placebo menée chez des patients atteints de granulomatose éosinophilique avec polyangéite, les effets indésirables les plus fréquemment rapportés au cours du traitement ont été : céphalées (32 %), réactions au site d’injection (15 %) et dorsalgies (13 %). Des réactions d’hypersensibilité/systémiques allergiques ont été rapportées par 4% de patients atteints de granulomatose éosinophilique avec polyangéite.
Syndrome hyperéosinophilique
Lors d’une étude contrôlée contre placebo menée chez des patients atteints de syndrome hyperéosinophilique, les effets indésirables les plus fréquemment rapportés au cours du traitement ont été : céphalées (13%), infections des voies urinaires (9%), réactions au site d'injection et fièvre (7% chacun).
Tableau des effets indésirables
Le tableau ci-dessous présente les effets indésirables observés : chez des patients traités par 100 mg de mépolizumab par voie sous cutanée (SC) (n=263) au cours des études contrôlées contre placebo dans l’asthme sévère à éosinophiles ; chez des patients présentant une polypose naso-sinusienne traités par 100 mg de mépolizumab par voie SC (n=206) au cours d’une étude de 52 semaines randomisée, en double aveugle, contrôlée contre placebo ; chez des patients présentant une BPCO traités par 100 mg de mépolizumab par voie SC (n=1043) au cours de 3 études contrôlées contre placebo en double aveugle d’une durée de 52 à 104 semaines ; chez des patients présentant une granulomatose éosinophilique avec polyangéite (n=68) traités par 300 mg de mépolizumab par voie SC ; chez des patients présentant un syndrome hyperéosinophilique traités par 300 mg de mépolizumab par voie SC (n=54) au cours d’une étude de 32 semaines en double aveugle, contrôlée contre placebo ; et à partir des notifications spontanées de pharmacovigilance depuis la commercialisation. Des données de sécurité sont également disponibles à partir des études d’extension en ouvert chez les patients présentant un asthme sévère réfractaire à éosinophiles (n=998) et traités pendant un temps médian de 2,8 ans (durée de traitement comprise entre 4 semaines et 4,5 ans).
Le profil de sécurité du mépolizumab chez les patients présentant un syndrome hyperéosinophilique (n=102) inclus dans une étude d’extension en ouvert de 20 semaines était similaire au profil de sécurité des patients inclus dans l’étude pivot contrôlée contre placebo.
La fréquence de survenue des effets indésirables est définie selon les critères suivants : très fréquent (≥ 1/10) ; fréquent (≥ 1/100 à < 1/10) ; peu fréquent (≥ 1/1 000 à < 1/100) ; rare (≥ 1/10 000 à < 1/1 000) ; très rare (< 1/10 000) ; et fréquence indéterminée (la fréquence de survenue ne peut être estimée sur la base des données disponibles). Dans chaque classe-organe, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
Classe organe | Effets indésirables | Fréquence | |
Infections et infestations | Infection pulmonaire | Fréquent | |
Affections du système immunitaire | Réactions d’hypersensibilité (systémiques allergiques) * | Fréquent | |
Affections du système nerveux | Céphalées | Très fréquent | |
Affections respiratoires, thoraciques et médiastinales | Congestion nasale | Fréquent | |
Affections gastro-intestinales | Douleur abdominale haute | Fréquent | |
Affections de la peau et du tissu sous-cutané | Eczéma | Fréquent | |
Affections musculo-squelettiques et systémiques | Dorsalgies | Fréquent | |
Troubles généraux et anomalies au site d'administration | Réactions liées à l’administration (systémiques non-allergiques)*** | Fréquent | |
* Des réactions systémiques, incluant des réactions d’hypersensibilité, ont été rapportées avec une incidence comparable à celle du placebo dans les études réalisées dans l’asthme sévère à éosinophiles et la BPCO. Voir rubrique 4.4., exemples des manifestations associées ayant été rapportées et leur délai de survenue.
** Effet identifié dans le cadre des déclarations spontanées depuis la commercialisation. Le zona était rapporté comme peu fréquent dans les études réalisées dans l’asthme sévère.
*** Les réactions systémiques non-allergiques liées à l’administration les plus fréquemment rapportées dans les études menées chez les patients présentant un asthme sévère à éosinophiles ou une BPCO ont été des éruptions cutanées, des bouffées vaso-motrices, des douleurs musculaires et une sensation de fatigue ; ces manifestations ont été rapportées peu fréquemment et chez <1 % des patients ayant reçu 100 mg de mépolizumab par voie sous-cutanée.
Description de certains effets indésirables
Réactions systémiques, incluant des réactions d'hypersensibilité associées à une polypose naso-sinusienne
Dans l’étude de 52 semaines contrôlée contre placebo, 2 patients (<1%) ont rapporté des réactions allergiques (hypersensibilité de type I) systémiques dans le groupe recevant 100 mg de mépolizumab et aucun patient dans le groupe placebo. Aucun patient n’a rapporté d'autres réactions systémiques dans le groupe recevant 100 mg de mépolizumab et 1 patient (<1%) dans le groupe placebo.
Réactions systémiques, incluant des réactions d'hypersensibilité associées à une bronchopneumopathie chronique obstructive
Dans l’étude d’une durée de 52 à 104 semaines contrôlée contre placebo, une réaction allergique systémique (hypersensibilité de type I) a été rapportée chez 1 patient (<1%) dans le groupe recevant 100 mg de mépolizumab mais aucune dans le groupe placebo. D’autres réactions systémiques ont été rapportées chez 4 patients (<1%) dans le groupe recevant 100 mg de mépolizumab et chez 4 patients (<1%) dans le groupe placebo.
Dans les 2 études d’une durée de 52 semaines contrôlée contre placebo, des réactions allergiques systémiques/d’hypersensibilité ont été rapportées chez 4 patients (<1%) dans les groupes recevant 100 mg de mépolizumab et chez 3 patients (<1%) dans les groupes placebo. Des réactions systémiques non-allergiques ont été rapportées chez 7 patients (1%) dans les groupes recevant 100 mg de mépolizumab et 10 patients (2%) dans les groupes placebo.
Réactions systémiques, incluant les réactions d’hypersensibilité associées à une granulomatose éosinophilique avec polyangéite
Dans l’étude de 52 semaines contrôlée versus placebo, le pourcentage de patients ayant développé des réactions systémiques (allergiques ou non) était de 6 % dans le groupe recevant 300 mg de mépolizumab et de 1 % dans le groupe placebo. Les réactions systémiques, allergiques ou d’hypersensibilité, ont été rapportées chez 4 % des patients dans le groupe recevant 300 mg de mépolizumab et chez 1 % des patients du groupe placebo. Des réactions systémiques non allergiques (angioœdème) ont été rapportées chez 1 (1 %) patient dans le groupe recevant 300 mg de mépolizumab, et chez aucun patient dans le groupe placebo.
Réactions systémiques incluant des réactions d’hypersensibilité associées à un syndrome hyperéosinophilique
Dans l’étude de 32 semaines contrôlée contre placebo, 1 patient (2%) a rapporté une réaction systémique (autre) dans le groupe recevant 300 mg de mépolizumab (réaction cutanée multifocale) et aucun patient dans le groupe placebo.
Réactions locales au site d’injection
Asthme sévère à éosinophiles
Dans les études cliniques contrôlées contre placebo, l’incidence des réactions locales au site d’injection rapportée avec 100 mg de mépolizumab administré par voie sous-cutanée a été de 8 % et 3 % avec le placebo. Tous les évènements rapportés étaient sans gravité, d’intensité légère à modérée et la majorité d’entre eux s’est résorbée en quelques jours. Les réactions locales au site d’injection sont survenues principalement à l’instauration du traitement et au cours des 3 premières injections ; ces réactions ont été moins fréquemment rapportées au cours des injections suivantes. Les manifestations les plus fréquemment rapportées au cours de ces réactions ont été douleur, érythème, gonflement, démangeaisons et sensation de brûlure.
Polypose naso-sinusienne
Dans l'étude contrôlée contre placebo, des réactions locales au site d'injection (par exemple érythème, prurit) sont survenues chez 2 % des patients recevant 100 mg de mépolizumab, comparé à < 1 % chez les patients recevant le placebo.
Bronchopneumopathie chronique obstructive
Dans les études contrôlées contre placebo, des réactions locales au site d’injection sont survenues chez 2% des patients recevant 100 mg de mépolizumab et chez 2% des patients recevant le placebo. Les manifestations les plus fréquemment rapportées ont été douleur, gonflement, démangeaisons et érythème.
Granulomatose éosinophilique avec polyangéite
Dans une étude contrôlée contre placebo, des réactions locales au site d’injection (par exemple : douleur, érythème, gonflement) sont survenues à un taux de 15 % chez les patients recevant 300 mg de mépolizumab, comparé à 13 % chez les patients recevant le placebo.
Syndrome hyperéosinophilique
Dans l’étude contrôlée contre placebo, des réactions locales au site d’injection (par exemple : brulures, démangeaisons) sont survenues à un taux de 7% chez les patients recevant 300 mg de mépolizumab comparé à 4% chez les patients recevant du placebo.
Population pédiatrique
Asthme sévère à éosinophiles
Trente-sept adolescents (âgés de 12-17 ans) ont été inclus dans quatre études d'une durée de 24 à 52 semaines, contrôlées contre placebo (25 patients traités par mépolizumab par voie intraveineuse ou sous-cutanée). Trente-six patients pédiatriques (âgés de 6-11 ans) ont reçu du mépolizumab par voie sous-cutanée pendant 12 semaines dans le cadre d’une étude en ouvert. Après une interruption de traitement de 8 semaines, 30 de ces patients ont reçu du mépolizumab pendant 52 semaines supplémentaires. Le profil de sécurité était similaire à celui observé chez l’adulte. Aucun effet indésirable supplémentaire n’a été identifié.
De plus, la sécurité à long terme du mépolizumab a été évaluée chez 9 patients adolescents (âgés de 12 à 17 ans) et 15 patients pédiatriques (âgés de 6 à 11 ans) inclus dans une étude d’extension en ouvert (étude 201956). Dans cette étude, les patients ont reçu du mépolizumab par voie sous-cutanée pendant une durée moyenne de 21,5 mois. Aucun effet indésirable supplémentaire n'a été identifié.
Syndrome hyperéosinophilique
Quatre adolescents âgés de 12 à 17 ans ont été inclus dans l’étude 200622 contrôlée contre placebo. Un adolescent a reçu 300 mg de mépolizumab et 3 adolescents ont reçu le placebo pendant 32 semaines. Tous les 4 ont poursuivi le traitement dans l’étude d’extension 205203 en ouvert de 20 semaines (voir rubrique 5.1).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé doivent déclarer tout effet indésirable suspecté via le système national de déclaration :
Belgique | Luxembourg |
7. TITULAIRE DE L'AUTORISATION DE MISE SUR LE MARCHE
GlaxoSmithKline Trading Services Limited
12 Riverwalk
Citywest Business Campus
Dublin 24
D24 YK11
Irlande
8. NUMERO(S) D'AUTORISATION DE MISE SUR LE MARCHE
EU/1/15/1043/001
EU/1/15/1043/002
10. DATE DE MISE A JOUR DU TEXTE
04 février 2026
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l'Agence européenne des médicaments https://www.ema.europa.eu.
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 3434750 | NUCALA PDR POUR SOL POUR SOL INJ FL 1 X 100MG | R03DX09 | € 1110,95 | - | Oui | € 12,8 | € 8,5 |
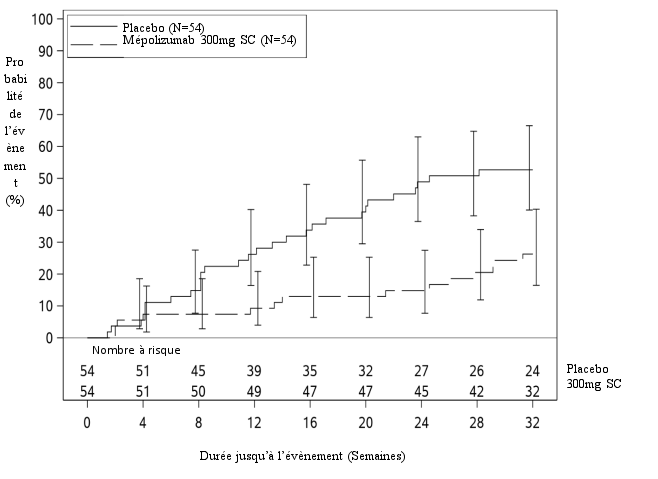 Figure 2 : Courbe de Kaplan Meier pour le délai de survenue de la première poussée de syndrome hyperéosinophilique
Figure 2 : Courbe de Kaplan Meier pour le délai de survenue de la première poussée de syndrome hyperéosinophilique