1. DÉNOMINATION DU MÉDICAMENT
Xolair 150 mg solution injectable en seringue préremplie
Xolair 300 mg solution injectable en seringue préremplie
Xolair 150 mg solution injectable en stylo prérempli
Xolair 300 mg solution injectable en stylo prérempli
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Xolair 150 mg solution injectable en seringue préremplie
Chaque seringue préremplie contient 150 mg d’omalizumab* dans 1 ml de solution.
Xolair 300 mg solution injectable en seringue préremplie
Chaque seringue préremplie contient 300 mg d’omalizumab* dans 2 ml de solution.
Xolair 150 mg solution injectable en stylo prérempli
Chaque stylo prérempli contient 150 mg d’omalizumab* dans 1 ml de solution.
Xolair 300 mg solution injectable en stylo prérempli
Chaque stylo prérempli contient 300 mg d’omalizumab* dans 2 ml de solution.
*L’omalizumab est un anticorps monoclonal humanisé produit sur une lignée cellulaire ovarienne de hamster chinois (CHO) (mammifères) par la technique de l’ADN recombinant.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Solution injectable (injection)
Solution claire à légèrement opalescente, incolore à jaune brunâtre pâle.
4. INFORMATIONS CLINIQUES
4.1 Indications thérapeutiques
Asthme allergique
Xolair est indiqué chez les adultes, adolescents et enfants (âgés de 6 ans à moins de 12 ans).
Le traitement par Xolair ne doit être envisagé que chez les patients présentant un asthme dont la dépendance aux IgE (immunoglobulines E) a été établie sur des critères probants (voir rubrique 4.2).
Adultes et adolescents (à partir de 12 ans)
Xolair est indiqué, en traitement additionnel, pour améliorer le contrôle de l’asthme chez les patients atteints d’asthme allergique persistant sévère, ayant un test cutané positif ou une réactivité in vitro à un pneumallergène perannuel, et qui, malgré un traitement quotidien par un corticoïde inhalé à forte dose et un bêta2-agoniste inhalé à longue durée d’action, présentent une réduction de la fonction pulmonaire (VEMS<80% de la valeur théorique), des symptômes diurnes ou des réveils nocturnes fréquents, et des exacerbations sévères, multiples et documentées de l’asthme.
Enfants (de 6 ans à moins de 12 ans)
Xolair est indiqué, en traitement additionnel, pour améliorer le contrôle de l’asthme chez les patients atteints d’asthme allergique persistant sévère, ayant un test cutané positif ou une réactivité in vitro à un pneumallergène perannuel, et qui, malgré un traitement quotidien par un corticoïde inhalé à forte dose et un bêta2-agoniste inhalé à longue durée d’action, présentent des symptômes diurnes ou des réveils nocturnes fréquents, et des exacerbations sévères, multiples et documentées de l’asthme.
Polypose naso-sinusienne
Xolair est indiqué, en traitement additionnel aux corticoïdes intranasaux, dans le traitement de la polypose naso-sinusienne sévère chez les adultes (à partir de 18 ans) insuffisamment contrôlés par les corticoïdes intranasaux.
Urticaire chronique spontanée
Xolair est indiqué, en traitement additionnel, dans le traitement de l’urticaire chronique spontanée chez les adultes et adolescents (à partir de 12 ans) présentant une réponse insuffisante aux traitements antihistaminiques anti-H1.
4.2 Posologie et mode d’administration
Le traitement doit être instauré par un médecin expérimenté dans le diagnostic et le traitement de l’asthme persistant sévère, de la polypose naso-sinusienne ou de l’urticaire chronique spontanée.
Posologie
Asthme allergique et polypose naso-sinusienne
La posologie suit les mêmes principes en cas d’asthme allergique et de polypose naso-sinusienne. La dose et la fréquence d’administration adaptées d’omalizumab pour ces maladies sont déterminées en fonction du taux initial d’IgE (UI/ml), mesuré avant le début du traitement, et du poids corporel (kg). Le taux d’IgE du patient devra être déterminé avant l’administration de la première dose par l’une des méthodes disponibles de dosage des IgE sériques totales afin de définir la dose à administrer. En fonction de ces mesures, une dose de 75 à 600 mg d’omalizumab en 1 à 4 injections pourra être nécessaire lors de chaque administration.
Les patients présentant un asthme allergique et un taux initial d’IgE inférieur à 76 UI/ml sont moins susceptibles de tirer un bénéfice du traitement (voir rubrique 5.1). Les médecins prescripteurs devront s’assurer que les patients adultes et adolescents chez qui le taux d’IgE est inférieur à 76 UI/ml ainsi que les enfants (de 6 ans à moins de 12 ans) chez qui le taux d’IgE est inférieur à 200 UI/ml ont une réactivité significative in vitro (RAST) à un allergène perannuel avant de débuter le traitement.
Voir le tableau 1 pour la table de conversion et les tableaux 2 et 3 pour les tables de détermination de la dose.
Les patients dont le taux initial d’IgE ou le poids corporel (kg) sont en dehors des valeurs limites figurant dans la table de détermination de la dose ne doivent pas être traités par l’omalizumab.
La dose maximale recommandée est de 600 mg d’omalizumab toutes les deux semaines.
Tableau 1 Correspondance de la dose pour chaque administration en nombre de seringues préremplies/stylos*, nombre d’injections** et volume total à injecter
Dose (mg) | Nombre de seringues/stylos* | Nombre d’injections | Volume total à injecter (ml) | ||
| 75 mg | 150 mg | 300 mg* |
|
|
75 | 1 | 0 | 0 | 1 | 0,5 |
150 | 0 | 1 | 0 | 1 | 1,0 |
225 | 1 | 1 | 0 | 2 | 1,5 |
300 | 0 | 0 | 1 | 1 | 2,0 |
375 | 1 | 0 | 1 | 2 | 2,5 |
450 | 0 | 1 | 1 | 2 | 3,0 |
525 | 1 | 1 | 1 | 3 | 3,5 |
600 | 0 | 0 | 2 | 2 | 4,0 |
*Xolair 300 mg sous forme de seringue préremplie et tous les dosages du stylo prérempli de Xolair ne sont pas destinés à être utilisés chez les patients d’âge <12 ans.
**Ce tableau représente le nombre minimum d’injections pour les patients, toutefois d’autres combinaisons de dosages seringue/stylo sont possibles pour administrer la dose souhaitée.
Tableau 2 ADMINISTRATION TOUTES LES 4 SEMAINES. Doses d’omalizumab (milligrammes par dose) administrées par injection sous-cutanée toutes les 4 semaines
| Poids corporel (kg) | |||||||||
Taux initial d’IgE (UI/ml) | 20‑ 25* | >25‑ | >30‑ | >40‑ | >50‑ | >60‑ | >70‑ | >80‑ | >90- | >125- |
30‑100 | 75 | 75 | 75 | 150 | 150 | 150 | 150 | 150 | 300 | 300 |
>100‑200 | 150 | 150 | 150 | 300 | 300 | 300 | 300 | 300 | 450 | 600 |
>200‑300 | 150 | 150 | 225 | 300 | 300 | 450 | 450 | 450 | 600 |
|
>300‑400 | 225 | 225 | 300 | 450 | 450 | 450 | 600 | 600 |
|
|
>400‑500 | 225 | 300 | 450 | 450 | 600 | 600 |
|
|
|
|
>500‑600 | 300 | 300 | 450 | 600 | 600 |
|
|
|
|
|
>600‑700 | 300 |
| 450 | 600 |
|
|
|
|
|
|
>700-800 |
|
|
|
|
|
|
|
|
|
|
>800-900 |
|
|
|
| ADMINISTRATION TOUTES LES 2 SEMAINES : VOIR TABLEAU 3 |
| ||||
>900-1 000 |
|
|
|
|
| |||||
>1 000-1 100 |
|
|
|
|
|
|
|
|
|
|
*Les essais pivots conduits dans la polypose naso-sinusienne n’ont pas étudié l’effet de Xolair chez les patients dont le poids corporel était inférieur à 30 kg.
Tableau 3 ADMINISTRATION TOUTES LES 2 SEMAINES. Doses d’omalizumab (milligrammes par dose) administrées par injection sous-cutanée toutes les 2 semaines
| Poids corporel (kg) | |||||||||||
Taux initial d’IgE (UI/ml) | 20‑ | >25‑ | >30‑ | >40‑ | >50‑ | >60‑ | >70‑ | >80‑ | >90- | >125- | ||
30‑100 | ADMINISTRATION TOUTES LES 4 SEMAINES : VOIR TABLEAU 2 |
|
|
|
|
| ||||||
>100‑200 |
|
|
|
|
| |||||||
>200‑300 |
|
|
|
|
|
|
|
|
| 375 | ||
>300‑400 |
|
|
|
|
|
|
|
| 450 | 525 | ||
>400‑500 |
|
|
|
|
|
| 375 | 375 | 525 | 600 | ||
>500‑600 |
|
|
|
|
| 375 | 450 | 450 | 600 |
| ||
>600‑700 |
| 225 |
|
| 375 | 450 | 450 | 525 |
|
| ||
>700‑800 | 225 | 225 | 300 | 375 | 450 | 450 | 525 | 600 |
|
| ||
>800‑900 | 225 | 225 | 300 | 375 | 450 | 525 | 600 |
|
|
| ||
>900-1 000 | 225 | 300 | 375 | 450 | 525 | 600 |
|
|
|
| ||
>1 000-1 100 | 225 | 300 | 375 | 450 | 600 |
|
|
|
|
| ||
>1 100-1 200 | 300 | 300 | 450 | 525 | 600 | Les données sont insuffisantes pour recommander une posologie | ||||||
>1 200-1 300 | 300 | 375 | 450 | 525 |
|
|
|
|
|
| ||
>1 300-1 500 | 300 | 375 | 525 | 600 |
|
|
|
|
|
| ||
*Les essais pivots conduits dans la polypose naso-sinusienne n’ont pas étudié l’effet de Xolair chez les patients dont le poids corporel était inférieur à 30 kg.
Durée du traitement, surveillance et adaptations posologiques
Asthme allergique
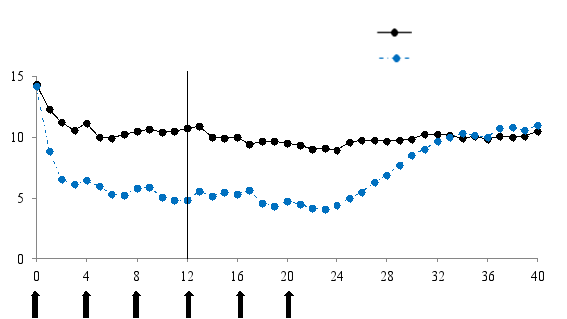
Xolair est destiné à un traitement à long terme. Les études cliniques ont démontré qu’un délai d’au moins 12 à 16 semaines peut être nécessaire pour bénéficier de l’efficacité du traitement. Après 16 semaines de traitement, l’efficacité du traitement devra être réévaluée par le médecin avant de poursuivre les injections. La décision de poursuivre le traitement après ces 16 semaines, ou par la suite, se basera sur l’observation d’une amélioration significative du contrôle de l’asthme (voir rubrique 5.1, Evaluation globale de l’efficacité du traitement par le médecin).
Polypose naso-sinusienne
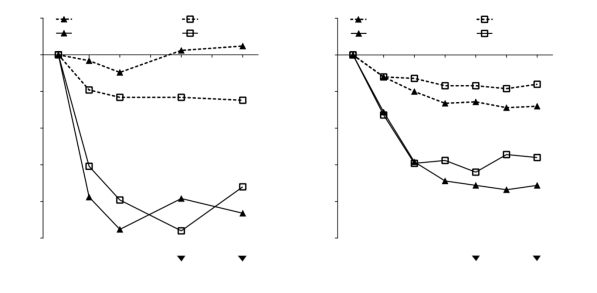
Dans les essais cliniques portant sur la polypose naso-sinusienne, des variations du score de polypose nasale (SPN) et du score de congestion nasale (CN) ont été observées à 4 semaines. La nécessité de poursuivre le traitement devra être réévaluée périodiquement en fonction de la sévérité de la maladie et du niveau de contrôle des symptômes.
Asthme allergique et polypose naso-sinusienne
L’arrêt du traitement entraîne généralement un retour à des taux élevés d’IgE circulantes et des symptômes associés. Les taux d’IgE totales peuvent être élevés au cours du traitement et peuvent le rester jusqu’à un an après l’arrêt du traitement. Par conséquent, un nouveau dosage du taux d’IgE au cours du traitement ne peut pas être utilisé pour déterminer les doses à administrer. Après une interruption de traitement de moins d’un an, la dose à administrer sera déterminée sur la base du taux d’IgE sériques mesuré lors de la détermination de la dose initiale. Si le traitement a été interrompu pendant un an ou plus, un nouveau dosage du taux d’IgE sériques totales pourra être réalisé pour déterminer la dose à administrer.
En cas de variation importante du poids corporel, les doses devront être réajustées (voir tableaux 2 et 3).
Urticaire chronique spontanée
La dose recommandée est de 300 mg en injection sous-cutanée toutes les quatre semaines. Chaque dose de 300 mg est administrée en une injection sous-cutanée de 300 mg ou en deux injections sous-cutanées de 150 mg.
Il est conseillé aux prescripteurs de régulièrement réévaluer la nécessité de poursuivre le traitement.
L’expérience clinique dans le traitement à long terme dans cette indication est décrite à la rubrique 5.1.
Populations particulières
Sujet âgé (65 ans et plus)
Les données disponibles sur l’utilisation de l’omalizumab chez le patient âgé de plus de 65 ans sont limitées, mais aucun élément ne suggère que les patients âgés aient besoin d’une dose différente de celle utilisée chez les patients adultes plus jeunes.
Insuffisance rénale ou hépatique
La pharmacocinétique de l’omalizumab n’a pas été étudiée en cas d’insuffisance rénale ou hépatique. La clairance de l’omalizumab aux doses utilisées en thérapeutique clinique faisant intervenir essentiellement le système réticulo-endothélial (SER), il est improbable qu’elle soit altérée par une insuffisance rénale ou hépatique. Même si aucune adaptation particulière de la posologie n’est préconisée pour ces patients, l’omalizumab doit être administré avec prudence (voir rubrique 4.4).
Population pédiatrique
Dans l’asthme allergique, la sécurité et l’efficacité de l’omalizumab chez les patients âgés de moins de 6 ans n’ont pas été établies. Aucune donnée n’est disponible.
Dans la polypose naso-sinusienne, la sécurité et l’efficacité de l’omalizumab chez les patients âgés de moins de 18 ans n’ont pas été établies. Aucune donnée n’est disponible.
Dans l’urticaire chronique spontanée, la sécurité et l’efficacité de l’omalizumab chez les patients âgés de moins de 12 ans n’ont pas été établies. Aucune donnée n’est disponible.
Mode d’administration
Réservé uniquement à l’administration par voie sous-cutanée. L’omalizumab ne doit pas être administré par voie intraveineuse ou intramusculaire.
Xolair 300 mg sous forme de seringue préremplie et tous les dosages du stylo prérempli de Xolair ne sont pas destinés à être utilisés chez les patients d’âge <12 ans. Xolair 75 mg sous forme de seringue préremplie et Xolair 150 mg sous forme de seringue préremplie peuvent être utilisées chez les enfants âgés de 6 à 11 ans présentant un asthme allergique.
Si plus d’une injection est nécessaire pour administrer la dose souhaitée, les injections doivent être réparties sur au moins deux sites d’injection (Tableau 1).
Chez les patients sans antécédents connus d’anaphylaxie, l’injection de Xolair peut, à partir de la 4ème dose et si un médecin juge cela possible, être réalisée par le patient lui-même (auto-administration) ou par un aidant (voir rubrique 4.4). Le patient ou l’aidant doit avoir été formé à la bonne technique d’injection et à la reconnaissance des premiers signes et symptômes de réactions allergiques graves.
Les patients ou les aidants doivent être informés qu'ils doivent injecter la quantité complète de Xolair conformément aux instructions d’utilisation fournies dans la notice.
4.3 Contre-indications
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.8 Effets indésirables
Asthme allergique et polypose naso-sinusienne
Résumé du profil de tolérance
Lors des essais cliniques conduits dans l’asthme allergique chez les adultes et les adolescents âgés d’au moins 12 ans, les événements indésirables les plus fréquemment rapportés ont été des maux de tête et des réactions au site d’injection, notamment une douleur, un gonflement, un érythème, un prurit au site d’injection. Dans les études cliniques menées chez des enfants âgés de 6 ans à moins de 12 ans, les effets indésirables les plus fréquemment rapportés ont été des céphalées, une fièvre et des douleurs abdominales hautes. La plupart de ces réactions ont été d’intensité légère ou modérée. Lors des essais cliniques conduits dans la polypose naso-sinusienne chez des patients âgés d’au moins 18 ans, les effets indésirables les plus fréquemment rapportés ont été des maux de tête, des étourdissements, des arthralgies, des douleurs abdominales hautes et des réactions au site d’injection.
Liste tabulée des effets indésirables
Le tableau 4 décrit par classe de systèmes d’organes MedDRA et fréquence, les effets indésirables signalés lors des essais cliniques pour la population globale traitée par Xolair pour un asthme allergique et une polypose naso-sinusienne et analysée pour la tolérance. Au sein de chaque groupe de fréquence, les effets indésirables doivent être présentés suivant un ordre décroissant de gravité. Les catégories de fréquences sont définies de la manière suivante : très fréquent (1/10), fréquent (≥1/100, <1/10), peu fréquent (≥1/1 000, <1/100), rare (≥1/10 000, <1/1 000) et très rare (<1/10 000). Les effets indésirables rapportés après commercialisation sont mentionnés sous la rubrique fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Tableau 4 Effets indésirables dans l’asthme allergique et la polypose naso-sinusienne
Infections et infestations | |
Peu fréquent | Pharyngite |
Rare | Infestation parasitaire |
Affections hématologiques et du système lymphatique | |
Fréquence indéterminée | Thrombopénie idiopathique, y compris cas sévères |
Affections du système immunitaire | |
Rare | Réaction anaphylactique, autres réactions allergiques graves, apparition d’anticorps anti-omalizumab |
Fréquence indéterminée | Maladie sérique, pouvant comprendre fièvre et lymphadénopathie |
Affections du système nerveux | |
Fréquent | Maux de tête* |
Peu fréquent | Syncope, paresthésies, somnolence, étourdissements# |
Affections vasculaires | |
Peu fréquent | Hypotension orthostatique, bouffées vasomotrices |
Affections respiratoires, thoraciques et médiastinales | |
Peu fréquent | Bronchospasme allergique, toux |
Rare | Œdème du larynx |
Fréquence indéterminée | Vascularite granulomateuse d’hypersensibilité (exemple syndrome de Churg-Strauss) |
Affections gastro-intestinales | |
Fréquent | Douleurs abdominales hautes**,# |
Peu fréquent | Signes et symptômes dyspeptiques, diarrhées, nausées |
Affections de la peau et du tissu sous-cutané | |
Peu fréquent | Photosensibilité, urticaire, éruption cutanée, prurit |
Rare | Angioedèmes |
Fréquence indéterminée | Alopécie |
Affections musculo-squelettiques et systémiques | |
Fréquent | Arthralgie† |
Rare | Lupus érythémateux disséminé (LED) |
Fréquence indéterminée | Myalgie, gonflement des articulations |
Troubles généraux et anomalies au site d’administration | |
Très fréquent | Fièvre** |
Fréquent | Réactions au site d’injection telles que gonflement, érythème, douleur, prurit |
Peu fréquent | Syndrome pseudo-grippal, gonflement au niveau des bras, prise de poids, fatigue |
* : Très fréquent chez les enfants de 6 ans à moins de 12 ans
** : Chez les enfants de 6 ans à moins de 12 ans
# : Fréquent dans les essais portant sur la polypose naso-sinusienne
† : Fréquence indéterminée dans les essais portant sur l’asthme allergique
Urticaire chronique spontanée
Résumé du profil de sécurité
La sécurité d’emploi et le profil de tolérance de l’omalizumab ont été étudiés aux doses de 75 mg, 150 mg et 300 mg administrées toutes les quatre semaines chez 975 patients présentant une urticaire chronique spontanée, dont 242 recevaient un placebo. Au total, 733 patients ont été traités par l’omalizumab jusqu’à 12 semaines et 490 patients jusqu’à 24 semaines. Parmi eux, 412 patients ont été traités jusqu’à 12 semaines et 333 patients ont été traités jusqu’à 24 semaines à la dose de 300 mg.
Liste tabulée des effets indésirables
Un tableau (Tableau 5 ci-dessous) présente de façon distincte les effets indésirables dans l’urticaire chronique spontanée, en raison des différences de posologie et de populations traitées (facteurs de risques, comorbidités, traitements concomitants et âges, significativement différents [exemple : les essais cliniques dans l’asthme ont inclus des enfants âgés de 6 à 12 ans])
Le tableau 5 ci-dessous décrit les effets indésirables (survenus chez ≥1% des patients quel que soit le groupe de traitement et ≥2% pour ceux plus fréquemment observés dans les groupes omalizumab qu’avec le placebo (après avis médical)) signalés à la dose de 300 mg dans les trois études de phase III regroupées. Les effets indésirables présentés sont divisés en deux groupes : ceux identifiés pendant la période de traitement de 12 semaines et ceux identifiés pendant la période de traitement de 24 semaines.
Les effets indésirables sont décrits par classe de systèmes d’organes MedDRA. Dans chaque classe de systèmes d’organes, les effets indésirables sont classés par fréquence en commençant par les plus fréquents. La fréquence de chaque effet indésirable est établie selon la définition conventionnelle suivante : très fréquent (1/10) ; fréquent (≥1/100, <1/10) ; peu fréquent (≥1/1 000, <1/100) ; rare (≥1/10 000, <1/1 000) ; très rare (<1/10 000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Tableau 5 Effets indésirables issus de la base de données regroupées de tolérance dans l’urticaire chronique spontanée (du jour 1 à la semaine 24) à la dose de 300 mg d’omalizumab
12 semaines | Etudes avec l’omalizumab 1, 2 et 3 Regroupées | Catégorie de fréquence | ||
Placebo N=242 | 300 mg N=412 |
| ||
Infections et infestations | ||||
Sinusite | 5 (2,1%) | 20 (4,9%) | Fréquent | |
Affections du système nerveux | ||||
Maux de tête | 7 (2,9%) | 25 (6,1%) | Fréquent | |
Affections musculo-squelettiques et systémiques | ||||
Arthralgie | 1 (0,4%) | 12 (2,9%) | Fréquent | |
Troubles généraux et anomalies au site d'administration | ||||
Réaction au site d’injection* | 2 (0,8%) | 11 (2,7%) | Fréquent | |
24 semaines | Etudes avec l’omalizumab 1 et 3 Regroupées | Catégorie de fréquence | ||
Placebo N=163 | 300 mg N=333 |
| ||
Infections et infestations | ||||
Infection des voies respiratoires supérieures | 5 (3,1%) | 19 (5,7%) | Fréquent | |
*Bien que l’on n’observe pas une différence de 2% par rapport au placebo, les réactions au site d’injection sont mentionnées dans la mesure où tous les cas ont été considérés comme étant liés au traitement de l’étude.
Dans une étude de 48 semaines, 81 patients atteints d’urticaire chronique spontanée ont reçu la dose de 300 mg d’omalizumab toutes les 4 semaines (voir rubrique 5.1). Le profil de sécurité de l’utilisation à long terme était comparable au profil de sécurité observé dans les études de 24 semaines dans l’urticaire chronique spontanée.
Description d’effets indésirables sélectionnés
Affections du système immunitaire
Pour plus d’informations, voir rubrique 4.4.
Anaphylaxie
Les réactions anaphylactiques rapportées lors des essais cliniques ont été rares. Toutefois, une recherche dans la base de données de Pharmacovigilance a permis d'identifier un total de 898 cas d’anaphylaxie rapportés depuis la commercialisation. L'exposition dans la population étant estimée à 566 923 patients-année, le taux de notification est d’environ 0,20 %.
Evènements thromboemboliques artériels
Dans les études cliniques contrôlées et au cours d’analyses intermédiaires d’une étude observationnelle, un déséquilibre numérique des évènements thromboemboliques artériels a été observé. La définition du critère composite "évènements thromboemboliques artériels" comprenait : accident vasculaire cérébral, accident ischémique transitoire, infarctus du myocarde, angor instable et décès d’origine cardiovasculaire (y compris les décès de cause inconnue). Dans l’analyse finale de l’étude observationnelle, l'incidence des évènements thromboemboliques artériels pour 1 000 patients-année a été de 7,52 (115/15 286 patients-année) pour les patients traités par Xolair et de 5,12 (51/9 963 patients-année) pour les patients du groupe contrôle. Dans une analyse multivariée contrôlant les facteurs de risque cardiovasculaires associés, le rapport de risque était de 1,32 (intervalle de confiance à 95%, 0,91‑1,91). Dans une analyse séparée d’études cliniques regroupées, incluant toutes les études randomisées en double aveugle, contrôlées contre placebo, d’une durée de 8 semaines ou plus, l’incidence des évènements thromboemboliques artériels pour 1 000 patients-année a été de 2,69 (5/1 856 patients-année) pour les patients traités par Xolair et de 2,38 (4/1 680 patients-année) pour les patients du groupe placebo (risque relatif 1,13, intervalle de confiance à 95%, 0,24‑5,71).
Plaquettes
Lors des essais cliniques, peu de patients ont présenté un nombre de plaquettes inférieur à la limite inférieure de la normale du laboratoire. Des cas isolés de thrombopénie idiopathique, y compris des cas sévères, ont été rapportés après commercialisation.
Infestations parasitaires
Chez des patients allergiques exposés de façon chronique au risque d’infestation par les helminthes, un essai contrôlé contre placebo a montré une légère augmentation, non statistiquement significative, du taux d’infestation parasitaire dans le groupe traité par l’omalizumab. L’évolution, la sévérité et la réponse au traitement des infestations n’ont pas été modifiées (voir rubrique 4.4).
Lupus érythémateux disséminé
Des cas de lupus érythémateux disséminé (LED) ont été rapportés au cours des essais cliniques et depuis la commercialisation de Xolair, chez des patients présentant un asthme modéré à sévère ou une urticaire chronique spontanée. Le mécanisme impliqué dans la survenue de LED n’est pas totalement établi.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via:
Belgique
Agence fédérale des médicaments et des produits de santé
www.afmps.be
Division Vigilance:
Site internet: www.notifieruneffetindesirable.be
e-mail: adr@fagg-afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy
ou Division de la pharmacie et des médicaments de la Direction de la santé
Site internet: www.guichet.lu/pharmacovigilance
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHÉ
Novartis Europharm Limited
Vista Building
Elm Park, Merrion Road
Dublin 4
Irlande
8. NUMÉRO(S) D’AUTORISATION DE MISE SUR LE MARCHÉ
Xolair 150 mg solution injectable en seringue préremplie
EU/1/05/319/008
EU/1/05/319/009
EU/1/05/319/010
EU/1/05/319/011
EU/1/05/319/024
EU/1/05/319/025
EU/1/05/319/026
Xolair 300 mg solution injectable en seringue préremplie
EU/1/05/319/012
EU/1/05/319/013
EU/1/05/319/014
Xolair 150 mg solution injectable en stylo prérempli
EU/1/05/319/027
EU/1/05/319/028
EU/1/05/319/029
Xolair 300 mg solution injectable en stylo prérempli
EU/1/05/319/015
EU/1/05/319/016
EU/1/05/319/017
10. DATE DE MISE À JOUR DU TEXTE
02.12.2024
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments http://www.ema.europa.eu
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 2687408 | XOLAIR 150 MG SOL INJ 1 SER PREREMPLI | R03DX05 | € 235,52 | - | Oui | € 12,5 | € 8,3 |