1. DENOMINATION DU MEDICAMENT
Actilyse 10 mg poudre et solvant pour solution injectable/perfusion
Actilyse 20 mg poudre et solvant pour solution injectable/perfusion
Actilyse 50 mg poudre et solvant pour solution injectable/perfusion
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Un flacon de poudre contient:
10 mg d’altéplase (correspondant à 5 800 000 UI) ou
20 mg d’altéplase (correspondant à 11 600 000 UI) ou
50 mg d’altéplase (correspondant à 29 000 000 UI) respectivement.
L’altéplase est produite par la technique de l’ADN recombinant à partir d’une lignée cellulaire CHO (Chinese Hamster Ovary).
L’activité spécifique de la substance de référence interne est de 580 000 UI/mg, cette valeur étant confirmée par comparaison avec le deuxième standard international de l’OMS pour le tPA. La spécification pour l’activité spécifique de l’altéplase est de 522 000 à 696 000 UI/mg.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Poudre et solvant pour solution injectable/perfusion.
La poudre se présente sous la forme d’un lyophilisat incolore à jaune pâle. La préparation reconstituée est une solution limpide, incolore à jaune pâle.
4. DONNEES CLINIQUES
4.1 Indications thérapeutiques
Traitement thrombolytique à la phase aiguë de l’infarctus du myocarde
– Schéma thérapeutique dit "accéléré" (90 minutes) (voir rubrique 4.2): destiné aux patients chez qui le traitement peut être débuté dans les 6 heures suivant l’apparition des symptômes.
– Schéma thérapeutique dit "des 3 heures" (voir rubrique 4.2): destiné aux patients chez qui le traitement peut être débuté entre 6 et 12 heures après l’apparition des symptômes, à condition que le diagnostic ait été clairement confirmé.
L’Actilyse permet de réduire le taux de mortalité à 30 jours après infarctus du myocarde.
Traitement thrombolytique après embolie pulmonaire massive à la phase aiguë avec instabilité hémodynamique
Le diagnostic devra être confirmé dans la mesure du possible par des méthodes objectives telles que l’angiographie pulmonaire ou d’autres méthodes non-invasives comme le scanner. Il n’existe pas de preuve d’un bénéfice en terme de morbi-mortalité dans cette indication.
Traitement fibrinolytique de l’accident vasculaire cérébral ischémique à la phase aiguë
Le traitement doit être instauré le plus tôt possible, dans les 4h30 suivant l’apparition des symptômes d’accident vasculaire cérébral et après avoir exclu une hémorragie intracrânienne par des techniques appropriées d’imagerie (par exemple, tomodensitométrie cérébrale ou autre méthode d’imagerie sensible pour le diagnostic d’une hémorragie). L’effet du traitement est dépendant du temps ; par conséquent, plus le traitement est administré précocement, plus les chances de résultat clinique favorable sont élevées.
4.2 Posologie et mode d’administration
Le traitement par l’Actilyse devra être instauré aussitôt que possible après l’apparition des symptômes. Les recommandations suivantes concernant la posologie doivent être appliquées:
Infarctus du myocarde à la phase aiguë
Posologie
a) Schéma posologique dit "accéléré" (90 minutes) adapté aux patients en phase aiguë de l’infarctus du myocarde pouvant être traités dans les 6 heures suivant l’apparition des symptômes.
Chez les patients de poids corporel supérieur ou égal à 65 kg :
| Volume à administrer en fonction de la concentration d’altéplase | |
1 mg/ml | 2 mg/ml | |
Bolus intraveineux de 15 mg, suivi immédiatement par | 15 ml | 7,5 ml |
Perfusion intraveineuse à débit constant de 50 mg sur les 30 premières minutes, suivi immédiatement par | 50 ml | 25 ml |
Perfusion intraveineuse à débit constant de 35 mg sur 60 minutes, sans dépasser la dose maximale totale de 100 mg | 35 ml | 17,5 ml |
Chez les patients de poids corporel inférieur à 65 kg, la dose totale doit être adaptée en fonction du poids selon le schéma d’administration suivant :
| Volume à administrer en fonction de la concentration d’altéplase | |
1 mg/ml | 2 mg/ml | |
Bolus intraveineux de 15 mg, suivi immédiatement par | 15 ml | 7,5 ml |
Perfusion intraveineuse à débit constant de 0,75 mg/kg de poids corporel (pc) sur les 30 premières minutes, suivi immédiatement par | 0,75 ml/kg (pc) | 0,375 ml/kg (pc) |
Perfusion intraveineuse à débit constant, de 0,5 mg/kg de poids corporel (pc) sur 60 minutes | 0,5 ml/kg (pc) | 0,25 ml/kg (pc) |
b) Schéma posologique dit "des 3 heures" adapté aux patients souffrant d’un infarctus du myocarde en phase aiguë, chez qui le traitement est mis en œuvre entre la 6e et la 12e heure suivant l’apparition des symptômes.
Chez les patients de poids corporel supérieur ou égal à 65 kg :
| Volume à administrer en fonction de la concentration d’altéplase | |
1 mg/ml | 2 mg/ml | |
Bolus intraveineux de 10 mg, suivi immédiatement par | 10 ml | 5 ml |
Perfusion intraveineuse à débit constant de 50 mg sur les 60 premières minutes, suivi immédiatement par | 50 ml | 25 ml |
Perfusion intraveineuse à débit constant de 40 mg sur 2 heures jusqu’à une dose maximale totale de 100 mg | 40 ml | 20 ml |
Chez les patients de poids corporel inférieur à 65 kg :
| Volume à administrer en fonction de la concentration d’altéplase | |
1 mg/ml | 2 mg/ml | |
Bolus intraveineux de 10 mg, suivi immédiatement par | 10 ml | 5 ml |
Perfusion intraveineuse à débit constant sur 3 heures, jusqu’à la dose maximale totale de 1,5 mg/kg de poids corporel (pc) | 1,5 ml/kg (pc) | 0,75 ml/kg (pc) |
Traitements associés
Un traitement adjuvant antithrombotique est recommandé conformément aux recommandations internationales actuelles concernant la prise en charge des patients présentant un infarctus du myocarde avec sus-décalage du segment ST.
Mode d’administration
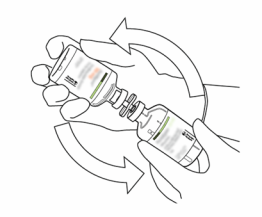
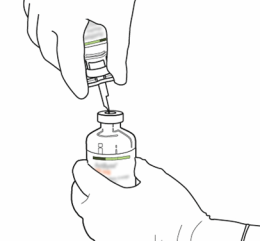
La solution reconstituée doit être administrée par voie intraveineuse et doit être utilisée immédiatement.
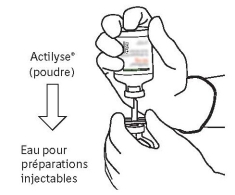
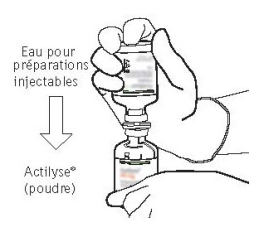
Les flacons de 2 mg d’altéplase ne sont pas adaptés pour une utilisation dans cette indication. Pour les instructions avant reconstitution/administration, voir rubrique 6.6.
Embolie pulmonaire massive à la phase aiguë
Posologie
Chez les patients de poids corporel supérieur ou égal à 65 kg :
Une dose totale de 100 mg d’altéplase doit être administrée en 2 heures. L’expérience acquise porte essentiellement sur le schéma posologique suivant:
| Volume à administrer en fonction de la concentration d’altéplase | |
1 mg/ml | 2 mg/ml | |
Bolus intraveineux de 10 mg sur 1 à 2 minutes, suivi immédiatement par | 10 ml | 5 ml |
perfusion intraveineuse à débit constant de 90 mg sur 2 heures jusqu’à une dose maximale de 100 mg de poids corporel (pc) | 90 ml | 45 ml |
Chez les patients de poids corporel inférieur à 65 kg :
| Volume à administrer en fonction de la concentration d’altéplase | |
1 mg/ml | 2 mg/ml | |
Bolus intraveineux de 10 mg sur 1 à 2 minutes, suivi immédiatement par | 10 ml | 5 ml |
Perfusion intraveineuse à débit constant sur 2 heures jusqu’à la dose maximale totale de 1,5 mg/kg | 1,5 ml/kg (pc) | 0,75 ml/kg (pc) |
Traitement associé
Après le traitement par Actilyse, une héparinothérapie doit être instaurée (ou reprise) si la valeur du aPTT est inférieure à deux fois la limite supérieure de la normale. La perfusion doit être ajustée afin de maintenir un aPTT de 50 à 70 secondes (1,5 à 2,5 fois la valeur de référence)
Mode d’administration
La solution reconstituée doit être administrée par voie intraveineuse et doit être utilisée immédiatement.
Les flacons de 2 mg d’altéplase ne sont pas adaptés pour une utilisation dans cette indication. Pour les instructions avant reconstitution/administration, voir rubrique 6.6.
Accident vasculaire cérébral ischémique à la phase aiguë
L’instauration et le suivi du traitement doivent obligatoirement s’effectuer sous la responsabilité d’un médecin formé et expérimenté en pathologies neurovasculaires (voir rubriques 4.3 et 4.4).
Le traitement par Actilyse doit être initié le plus tôt possible, dans les 4h30 suivant l’apparition des symptômes (voir rubrique 4.4). Au-delà de 4h30 après l’apparition des symptômes de l’AVC, l’administration d’Actilyse est associée à un rapport bénéfice/risque défavorable, Actilyse ne doit donc pas être administré (voir rubrique 5.1).
Posologie
La posologie totale recommandée est de 0,9 mg d’altéplase/kg de poids corporel (dose maximale de 90 mg) en commençant par 10% de la dose totale devant être administrée comme bolus intraveineux initial, suivi immédiatement par une perfusion intraveineuse de la dose totale restante sur 60 minutes.
TABLE DES DOSES POUR L’AVC ISCHÉMIQUE A LA PHASE AIGUË | |||
En utilisant la concentration standard recommandée de 1 mg/ml, le volume (ml) à administrer est égal à la valeur de la dose recommandée (mg) | |||
Poids | Dose totale | Dose en bolus | Dose en perfusion*
|
40 | 36,0 | 3,6 | 32,4 |
42 | 37,8 | 3,8 | 34,0 |
44 | 39,6 | 4,0 | 35,6 |
46 | 41,4 | 4,1 | 37,3 |
48 | 43,2 | 4,3 | 38,9 |
50 | 45,0 | 4,5 | 40,5 |
52 | 46,8 | 4,7 | 42,1 |
54 | 48,6 | 4,9 | 43,7 |
56 | 50,4 | 5,0 | 45,4 |
58 | 52,2 | 5,2 | 47,0 |
60 | 54,0 | 5,4 | 48,6 |
62 | 55,8 | 5,6 | 50,2 |
64 | 57,6 | 5,8 | 51,8 |
66 | 59,4 | 5,9 | 53,5 |
68 | 61,2 | 6,1 | 55,1 |
70 | 63,0 | 6,3 | 56,7 |
72 | 64,8 | 6,5 | 58,3 |
74 | 66,6 | 6,7 | 59,9 |
76 | 68,4 | 6,8 | 61,6 |
78 | 70,2 | 7,0 | 63,2 |
80 | 72,0 | 7,2 | 64,8 |
82 | 73,8 | 7,4 | 66,4 |
84 | 75,6 | 7,6 | 68,0 |
86 | 77,4 | 7,7 | 69,7 |
88 | 79,2 | 7,9 | 71,3 |
90 | 81,0 | 8,1 | 72,9 |
92 | 82,8 | 8,3 | 74,5 |
94 | 84,6 | 8,5 | 76,1 |
96 | 86,4 | 8,6 | 77,8 |
98 | 88,2 | 8,8 | 79,4 |
100+ | 90,0 | 9,0 | 81,0 |
*administré à une concentration de 1 mg/ml sur 60 minutes, en perfusion à débit constant.
Traitement associé
La tolérance et l’efficacité de ce traitement en association avec l’héparine ou un antiaggrégant plaquettaire comme l’acide acétylsalicylique au cours des 24 premières heures suivant l’apparition des symptômes n’ont pas été suffisamment étudiées. Par conséquent, l’administration d’héparine par voie intraveineuse ou d’un antiaggrégant plaquettaire comme l’acide acétylsalicylique doit être évitée au cours des premières 24 heures suivant l’administration d’Actilyse en raison d’un risque hémorragique augmenté. Si l’administration d’héparine est rendue nécessaire pour d’autres indications (par exemple en prévention de thrombose veineuse profonde), la posologie ne doit pas dépasser 10 000 UI par jour, par voie sous-cutanée.
Mode d’administration
La solution reconstituée doit être administrée par voie intraveineuse et doit être utilisée immédiatement.
Les flacons de 2 mg d’altéplase ne sont pas adaptés pour une utilisation dans cette indication.
Pour les instructions avant reconstitution/administration, voir rubrique 6.6.
Population pédiatrique
L’expérience de l’utilisation d’Actilyse chez les enfants et les adolescents est encore limitée. Actilyse est contre-indiqué pour le traitement de l’accident vasculaire cérébral ischémique à la phase aiguë chez les enfants et les adolescents âgés de moins de 16 ans (voir rubrique 4.3). La dose pour les adolescents âgés de 16-17 ans est la même que pour les adultes (voir rubrique 4.4 pour les recommandations sur les techniques d’imageries à utiliser en amont).
4.3 Contre-indications
Hypersensibilité connue à la substance active ou à l’un des excipients mentionnés dans la rubrique 6.1.
Contre-indications dans les indications d’infarctus du myocarde à la phase aiguë, d’embolie pulmonaire massive à la phase aiguë, d’accident vasculaire cérébral ischémique à la phase aiguë
Actilyse est contre-indiqué dans tous les cas associés à un risque hémorragique élevé:
– trouble hémorragique significatif actuel ou au cours des six derniers mois
– diathèse hémorragique connue
– traitement concomitant par des anticoagulants oraux à dose efficace, (p.ex. warfarine avec INR>1.3) (voir rubrique 4.4)
– hémorragie sévère ou potentiellement dangereuse, manifeste ou récente
– antécédents ou suspicion d’hémorragie intracrânienne
– suspicion d’hémorragie sous-arachnoïdienne ou antécédents d’hémorragie sous-arachnoïdienne liée à un anévrisme
– antécédents de lésion sévère du système nerveux central (p.ex. néoplasie, anévrisme, intervention chirurgicale intracérébrale ou intra-rachidienne)
– massage cardiaque externe traumatique récent (moins de 10 jours), accouchement, ponction récente d’un vaisseau non accessible à la compression (p.ex., ponction de la veine sous-clavière ou jugulaire)
– hypertension artérielle sévère non contrôlée
– endocardite bactérienne, péricardite
– pancréatite aiguë
– ulcères gastro-intestinaux documentés au cours des 3 derniers mois, varices œsophagiennes, anévrisme artériel, malformations artérielles ou veineuses
– néoplasie majorant le risque hémorragique
– hépatopathie sévère, y compris insuffisance hépatique, cirrhose, hypertension portale (varices œsophagiennes) et hépatite évolutive
– intervention chirurgicale ou traumatismes importants au cours des 3 derniers mois.
Contre-indications complémentaires dans l’indication d’infarctus du myocarde à la phase aiguë
– tout antécédent connu d’accident vasculaire cérébral hémorragique ou d’origine inconnue
– antécédents connus d’accident vasculaire cérébral ischémique ou d’accident ischémique transitoire (AIT) au cours des six mois précédents, sauf si l’accident vasculaire cérébral ischémique à la phase aiguë est survenu dans les 4h30 précédentes.
Contre-indications complémentaires dans l’indication d’embolie pulmonaire massive à la phase aiguë
– tout antécédent connu d’accident vasculaire cérébral hémorragique ou d’origine inconnue
– antécédents connus d’accident vasculaire cérébral ischémique ou d’accident ischémique transitoire (AIT) au cours des six mois précédents, sauf si l’accident vasculaire cérébral ischémique aigu est survenu dans les 4h30 précédentes.
Contre-indications complémentaires dans l’indication d’accident vasculaire cérébral ischémique à la phase aiguë
– symptômes d’accident vasculaire cérébral ischémique apparus plus de 4h30 avant l’initiation du traitement ou dont l’heure d’apparition est inconnue et pourrait potentiellement être supérieure à 4h30 (voir rubrique 5.1)
– déficit neurologique mineur ou symptômes s’améliorant rapidement avant l’initiation du traitement
– accident vasculaire cérébral jugé sévère cliniquement (par exemple NIHSS > 25) et/ou par technique d’imagerie
– crise convulsive au début de l’accident vasculaire cérébral
– signes d’hémorragie intracrânienne (HIC) au scanner CT
– symptômes suggérant une hémorragie sous-arachnoïdienne, même en l’absence d’anomalie au scanner CT
– administration d’héparine au cours des 48 heures précédentes avec un temps de thromboplastine dépassant la limite supérieure de la normale du laboratoire
– patients diabétiques présentant des antécédents d’accident vasculaire cérébral
– antécédent d’accident vasculaire cérébral au cours des 3 derniers mois
– plaquettes inférieures à 100 000/mm3
– pression artérielle systolique >185 mm Hg ou pression artérielle diastolique > 110 mm Hg, ou traitement agressive (par voie intraveineuse) nécessaire pour réduire la pression artérielle à ces valeurs seuils
– glycémie inférieure à 50 mg/dl ou supérieure à 400 mg/dl (< 2,8mmol/l ou > 22,2 mmol/l).
Utilisation chez l’enfant et l’adolescent
Actilyse n’est pas indiqué pour le traitement de l’accident vasculaire cérébral à la phase aiguë chez les enfants âgés de moins de 16 ans (pour les adolescents âgés de 16 ans ou plus, voir rubrique 4.4).
4.8 Effets indésirables
Les effets indésirables les plus fréquemment associés à l’administration d’Actilyse sont les hémorragies, sous différentes formes, associées à une chute d’hématocrite et/ou de l’hémoglobinémie.
Les effets indésirables cités ci-dessous sont présentés par fréquence et par classe de systèmes d’organes. Les groupes de fréquence sont définis selon la convention suivante: Très fréquent (≥1/10), Fréquent (≥1/100, <1/10), Peu fréquent (≥1/1.000, <1/100), Rare (≥1/10.000, <1/1.000), Très rare (<1/10.000), Fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
A l’exception des cas d’hémorragies intracrâniennes comme effet indésirable pour le traitement de l’accident vasculaire cérébral et des cas d’arythmies de reperfusion pour le traitement de l’infarctus du myocarde à la phase aiguë, aucune raison médicale ne laisse supposer que le profil qualitatif et quantitatif des effets indésirables d’Actilyse puisse être différent dans le cadre du traitement de l’embolie pulmonaire massive à la phase aiguë et de l’accident vasculaire cérébral ischémique à la phase aiguë ou dans le cadre du traitement de l’infarctus du myocarde à la phase aiguë .
Tableau 1 Effets indésirables dans les indications d’infarctus du myocarde à la phase aiguë, d’embolie pulmonaire massive à la phase aiguë et d’accident vasculaire cérébral ischémique à la phase aiguë
Classe de systèmes d’organes | Effet indésirable |
Hémorragies | |
Très fréquent | L’hémorragie intracérébrale représente le principal effet indésirable dans le traitement de l’accident vasculaire cérébral ischémique aigu |
Fréquent | Hémorragie intracérébrale (telle qu’hémorragie cérébrale, hématome cérébral, accident vasculaire cérébral hémorragique, transformation hémorragique d’un accident vasculaire cérébral, hématome intracrânien, hémorragie sous-arachnoïdienne) en cas de traitement d’un infarctus du myocarde aigu ou d’une embolie pulmonaire massive à la phase aiguë |
Peu fréquent | Hémorragie pulmonaire (telle que hémoptysie, hémothorax, hémorragie des voies respiratoires) |
Rare | Saignements oculaires |
Fréquence indéterminée*** | Saignements des organes parenchymateux (tel que hémorragie hépatique). |
Affections du système immunitaire | |
Rare | Réactions d’hypersensibilité (par exemple éruption cutanée, urticaire, bronchospasme, œdème de Quincke, hypotension, choc)* |
Très rare | Anaphylaxie grave |
Affections du système nerveux | |
Très rare | Evènements d’origine centrale (par exemple crise d’épilepsie, convulsions, aphasie, troubles de la parole, delires, troubles neuropsychiatriques aigus, agitation, confusion, dépression, psychose), souvent associés à des évènements cérébrovasculaires d’origine ischémique ou hémorragique |
Affections cardiaques** | |
Très fréquent | Ischémie myocardique/angor récurrent(e), hypotension et insuffisance cardiaque/ œdème pulmonaire |
Fréquent | Choc cardiogénique, arrêt cardiaque et récidive d’infarctus |
Peu fréquent | Arythmies de reperfusion (tel qu’arythmie, extrasystole, bloc auriculo-ventriculaire du 1er degré jusqu’au bloc complet, fibrillation/flutter auriculaire, bradycardie, tachycardie, arythmie ventriculaire, tachycardie/fibrillation ventriculaire, dissociation électromagnétique) |
Affections vasculaires | |
Rare | Embolie pouvant avoir des conséquences dans les organes affectés |
Fréquence indéterminée*** |
|
Affections gastro-intestinales | |
Rare | Nausées |
Fréquence indéterminée*** | Vomissements |
Investigations | |
Peu fréquent | Diminution de la pression artérielle |
Fréquence indéterminée*** | Augmentation de la température corporelle |
Lésions, intoxications et complications liées aux procédures | |
Fréquence indéterminée*** | Embolie graisseuse (embolie par des cristaux de cholestérol) pouvant avoir des conséquences dans les organes affectés |
Actes médicaux et chirurgicaux | |
Fréquence indéterminée*** | Nécessité d’une transfusion sanguine |
*Voir les rubriques 4.4 et 4.5
**Affections cardiaques
Comme avec les autres agents thrombolytiques, les évènements décrits ci-dessus dans la section respective ont été rapportés en tant que séquelles d’un infarctus du myocarde ou d’un traitement thrombolytique. Ces événements cardiaques peuvent menacer le pronostic vital et entraîner le décès.
***Calcul des fréquences
Cet effet indésirable a été observé après la commercialisation. Avec 95% de certitude, la catégorie de fréquence n’est pas supérieure à « rare », mais pourrait être plus faible. L’estimation précise de la fréquence n’est pas possible car l’effet indésirable n’a pas été décrit dans la base de données des 8299 patients des essais cliniques.
Des décès et des handicaps irréversibles ont été rapportés chez des patients ayant présenté un accident vasculaire cérébral (y compris des saignements intracrâniens) ou d’autres épisodes de saignements graves.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration:
Belgique
Agence Fédérale des Médicaments et des Produits de Santé - www.afmps.be
Division Vigilance:
Site internet: www.notifieruneffetindesirable.be
e-mail: adr@fagg-afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy ou Division de la pharmacie et des médicaments de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
Boehringer Ingelheim SComm
Avenue Arnaud Fraiteur 15-23
1050 Bruxelles
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
Belgique :
Actilyse 10 mg poudre et solvant pour solution injectable/perfusion: BE154341
Actilyse 20 mg poudre et solvant pour solution injectable/perfusion: BE140332
Actilyse 50 mg poudre et solvant pour solution injectable/perfusion: BE140323
Luxembourg :
Actilyse 10 mg poudre et solvant pour solution injectable/perfusion: LU2000055880
- NN 0168162 : 1*1 flacon + 1*1 flacon de solvant 10 ml
Actilyse 20 mg poudre et solvant pour solution injectable/perfusion: LU2000055879
- NN 0138633 : 1*1 flacon + 1*1 flacon de solvant 20 ml
Actilyse 50 mg poudre et solvant pour solution injectable/perfusion: LU2000055878
- NN 0138647 : 1*1 flacon + 1*1 flacon de solvant 10 ml
10. DATE DE MISE A JOUR DU TEXTE
Date d’approbation : 09/2024
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 0656835 | ACTILYSE FL IV 1 X 50 MG + SOLV | B01AD02 | - | € 460,21 | Oui | - | - |
| 0685479 | ACTILYSE FL INJ 1 X 20 MG + SOLV | B01AD02 | - | € 226,89 | Oui | - | - |