ANNEXE I
RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
1. DÉNOMINATION DU MÉDICAMENT
Lonsurf 15 mg / 6,14 mg, comprimés pelliculés.
Lonsurf 20 mg / 8,19 mg, comprimés pelliculés.
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Lonsurf 15 mg / 6,14 mg, comprimés pelliculés
Chaque comprimé pelliculé contient 15 mg de trifluridine et 6,14 mg de tipiracil (sous forme de chlorhydrate).
Excipient à effet notoire : chaque comprimé pelliculé contient 90,735 mg de lactose monohydraté.
Lonsurf 20 mg / 8,19 mg, comprimés pelliculés
Chaque comprimé pelliculé contient 20 mg de trifluridine et 8,19 mg de tipiracil (sous forme de chlorhydrate).
Excipient à effet notoire : chaque comprimé pelliculé contient 120,980 mg de lactose monohydraté.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Comprimé pelliculé.
Lonsurf 15 mg / 6,14 mg, comprimés pelliculés
Le comprimé est blanc, biconvexe, rond, pelliculé, d’un diamètre de 7.1 mm, d’une épaisseur de 2.7 mm et porte les inscriptions «15» sur une face, et « 102 » et « 15 mg » sur l’autre face, à l'encre grise.
Lonsurf 20 mg / 8,19 mg, comprimés pelliculés
Le comprimé est rouge pâle, biconvexe, rond, pelliculé, d’un diamètre de 7.6 mm, d’une épaisseur de 3.2 mm et porte les inscriptions «20» sur une face, et « 102 » et « 20 mg » sur l’autre face, à l'encre grise.
4. INFORMATIONS CLINIQUES
4.1 Indications thérapeutiques
Cancer colorectal
Lonsurf est indiqué en association au bévacizumab chez les adultes atteints d’un cancer colorectal métastatique (CCRm) précédemment traités par deux protocoles de traitement comprenant les chimiothérapies à base de fluoropyrimidine, d’oxaliplatine et d’irinotecan, les agents anti-VEGF et/ou les agents anti-EGFR,
Lonsurf est indiqué en monothérapie chez les adultes atteints d’un cancer colorectal métastatique :
- précédemment traités par les traitements disponibles comprenant les chimiothérapies à base de fluoropyrimidine, d’oxaliplatine et d’irinotecan, les agents anti-VEGF et les agents anti-EGFR,
- ou qui ne sont pas éligibles à ces traitements.
Cancer gastrique
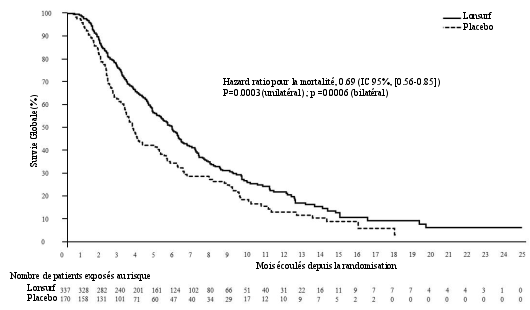
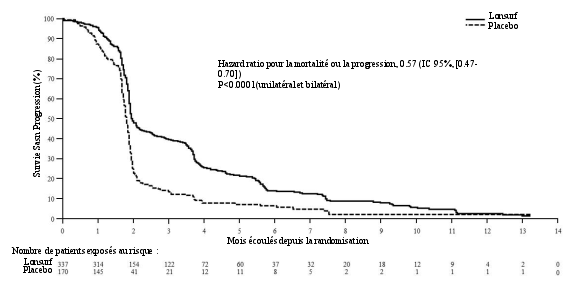
Lonsurf est indiqué en monothérapie dans le traitement de patients adultes atteints d’un cancer gastrique métastatique (CGm) incluant l’adénocarcinome de la jonction gastro-œsophagienne ayant été précédemment traités avec au moins deux protocoles de traitement systémique au stade avancé de la maladie (voir rubrique 5.1).
4.2 Posologie et mode d’administration
Lonsurf doit être prescrit par des médecins expérimentés dans l'utilisation des traitements anticancéreux.
Posologie
Chez l’adulte, la dose initiale recommandée, en monothérapie ou en association au bévacizumab, est 35 mg/m2/dose administrée par voie orale, à raison de 2 administrations par jour, aux Jours 1 à 5 puis aux Jours 8 à 12 de chaque cycle de traitement (1 cycle de traitement = 28 jours). Le traitement doit être poursuivi jusqu'à la progression de la maladie ou jusqu'à l’apparition d’une toxicité inacceptable (voir rubrique 4.4).
Lorsque Lonsurf est utilisé en association au bévacizumab dans le traitement d’un CCR métastatique, la dose de bévacizumab est de 5 mg/kg de poids corporel administré 1 fois toutes les 2 semaines. Veuillez consulter l’information produit complète de bévacizumab.
La dose à prendre lors de chaque administration doit être calculée en fonction de la surface corporelle (SC) (voir Tableau 1). La dose ne doit pas dépasser 80 mg/dose.
Le patient ne doit pas compenser les doses oubliées ou non prises.
Tableau 1 – Calcul de la dose initiale en fonction de la SC
Dose initiale | SC | Dose par administration en mg | Nombre de comprimés par administration | Dose journalière totale (mg) | |
15 mg/6,14 mg | 20 mg/8,19 mg | ||||
35 mg/m2 | < 1,07 | 35 | 1 | 1 | 70 |
1,07 – 1,22 | 40 | 0 | 2 | 80 | |
1,23 – 1,37 | 45 | 3 | 0 | 90 | |
1,38 – 1,52 | 50 | 2 | 1 | 100 | |
1,53 – 1,68 | 55 | 1 | 2 | 110 | |
1,69 – 1,83 | 60 | 0 | 3 | 120 | |
1,84 – 1,98 | 65 | 3 | 1 | 130 | |
1,99 – 2,14 | 70 | 2 | 2 | 140 | |
2,15 – 2,29 | 75 | 1 | 3 | 150 | |
≥ 2,30 | 80 | 0 | 4 | 160 | |
Ajustements posologiques recommandés
Des ajustements posologiques peuvent s’avérer nécessaires en fonction de la sécurité et de la tolérance individuelles du patient.
Un maximum de 3 réductions de doses est autorisé, sans descendre sous la dose minimale de 20 mg/m2 2 fois par jour. La dose ne doit ensuite pas être ré-augmentée si elle avait précédemment été réduite.
En cas de toxicités hématologiques et/ou non hématologiques, les patients doivent respecter les critères d’interruption et de reprise du traitement, ainsi que les modalités de réduction des doses administrées, mentionnés dans le Tableau 2, le Tableau 3 et le Tableau 4.
Tableau 2 – Critères d'interruption et de reprise du traitement en cas de toxicité hématologique liée à la myélosuppression
Paramètre | Critère d’interruption | Critère de reprise a |
Neutrophiles | < 0,5 109/l | 1,5 109/l |
Plaquettes | < 50 109/l | 75 109/l |
a Critères de reprise du traitement appliqués pour l’initiation du cycle de traitement suivant, et ce pour tous les patients, indépendamment du fait que les critères d’interruption aient été atteints.
Tableau 3 – Adaptations posologiques recommandées en cas d'effets indésirables hématologiques ou non hématologiques
Effet indésirable | Adaptation posologique recommandée |
|
|
*Terminologie usuelle de classification des événements indésirables
Tableau 4 – Calcul de la dose par administration en fonction de la SC lors des diminutions de dose
Dose après réduction | SC | Dose par administration en mg | Nombre de comprimés par administration | Dose journalière totale (mg) | ||
15 mg/6,14 mg | 20 mg/8,19 mg | |||||
Diminution de dose de niveau 1 : diminution de 35 mg/m2 à 30 mg/m2 par administration | ||||||
30 mg/m2 | < 1,09 | 30 | 2 | 0 | 60 | |
1,09 – 1,24 | 35 | 1 | 1 | 70 | ||
1,25 – 1,39 | 40 | 0 | 2 | 80 | ||
1,40 – 1,54 | 45 | 3 | 0 | 90 | ||
1,55 – 1,69 | 50 | 2 | 1 | 100 | ||
1,70 – 1,94 | 55 | 1 | 2 | 110 | ||
1,95 – 2,09 | 60 | 0 | 3 | 120 | ||
2,10 – 2,28 | 65 | 3 | 1 | 130 | ||
≥ 2,29 | 70 | 2 | 2 | 140 | ||
Diminution de dose de niveau 2 : diminution de 30 mg/m2 à 25 mg/m2 par administration | ||||||
25 mg/m2 | < 1,10 | 25a | 2a | 1a | 50a | |
1,10 – 1,29 | 30 | 2 | 0 | 60 | ||
1,30 – 1,49 | 35 | 1 | 1 | 70 | ||
1,50 – 1,69 | 40 | 0 | 2 | 80 | ||
1,70 – 1,89 | 45 | 3 | 0 | 90 | ||
1,90 – 2,09 | 50 | 2 | 1 | 100 | ||
2,10 – 2,29 | 55 | 1 | 2 | 110 | ||
≥ 2,30 | 60 | 0 | 3 | 120 | ||
Diminution de dose de niveau 3 : diminution de 25 mg/m2 à 20 mg/m2 par administration | ||||||
20 mg/m2 | < 1,14 | 20 | 0 | 1 | 40 | |
1,14 – 1,34 | 25a | 2a | 1a | 50a | ||
1,35 – 1,59 | 30 | 2 | 0 | 60 | ||
1,60 – 1,94 | 35 | 1 | 1 | 70 | ||
1,95 – 2,09 | 40 | 0 | 2 | 80 | ||
2,10 – 2,34 | 45 | 3 | 0 | 90 | ||
≥ 2,35 | 50 | 2 | 1 | 100 | ||
a Pour une dose journalière totale de 50 mg, les patients doivent prendre 1 comprimé de Lonsurf 20 mg/8,19 mg le matin et 2 comprimés de Lonsurf 15 mg/6,14 mg mg le soir.
Populations particulières
Insuffisance rénale
- Insuffisance rénale légère (60<clairance de la créatinine [CLcr]<89 ml/min) ou modérée (30<[CLcr]<59 ml/min) :
Aucune modification de la posologie initiale n’est recommandée pour les patients avec une insuffisance rénale légère ou modérée (voir rubriques 4.4 et 5.2).
- Insuffisance rénale sévère (15≤[CLcr]≤29 ml/min) :
Une dose d’initiation de 20 mg/m2, 2 fois par jour est recommandée pour les patients avec une insuffisance rénale sévère (voir rubriques 4.4 et 5.2). La dose peut être diminuée à un minimum de 15 mg/m2, 2 fois par jour, en fonction de l’état de santé et de la tolérance du patient (voir tableau 5). Après réduction de la dose, aucune augmentation de dose n’est autorisée
En cas de toxicité hématologique et/ou non-hématologique, les patients doivent suivre les critères d’interruption, de reprise et de diminution de dose indiqués dans le tableau 2, le tableau 3 et le tableau 5.
Tableau 5 – Dose d’initiation et diminution de dose chez les patients avec insuffisance rénale sévère en fonction de la SC
Dose après réduction | SC | Dose par administration en mg | Nombre de comprimés par administration | Dose journalière totale (mg) | |
15 mg/6.14 mg | 20 mg/8.19 mg | ||||
Dose d’initiation | |||||
20 mg/m2 | < 1,14 | 20 | 0 | 1 | 40 |
1,14 – 1,34 | 25a | 2a | 1a | 50a | |
1,35 – 1,59 | 30 | 2 | 0 | 60 | |
1,60 – 1,94 | 35 | 1 | 1 | 70 | |
1,95 – 2,09 | 40 | 0 | 2 | 80 | |
2,10 – 2,34 | 45 | 3 | 0 | 90 | |
≥ 2,35 | 50 | 2 | 1 | 100 | |
Diminution de dose : diminution de 20 mg/m2 à 15 mg/m2 par administration | |||||
15 mg/m2 | < 1,15 | 15 | 1 | 0 | 30 |
1,15 – 1,49 | 20 | 0 | 1 | 40 | |
1,50 – 1,84 | 25a | 2a | 1a | 50a | |
1,85 – 2,09 | 30 | 2 | 0 | 60 | |
2,10 – 2,34 | 35 | 1 | 1 | 70 | |
≥ 2,35 | 40 | 0 | 2 | 80 | |
a A la dose journalière totale de 50 mg, le patient doit prendre 1 comprimé dosé à 20 mg/8.19 mg le matin et deux comprimés dosés à 15 mg/6.14 mg le soir.
- Stade terminal d’insuffisance rénale ([CLcr]<15 ml/min ou patients pour lesquels des dialyses sont nécessaires) :
En l’absence de données disponibles, Lonsurf n’est pas recommandé chez les patients en stade terminal d’insuffisance rénale (voir rubrique 4.4).
Insuffisance hépatique
- Insuffisance hépatique légère :
Aucune modification de la posologie initiale n’est nécessaire en cas d’insuffisance hépatique légère (voir rubrique 5.2).
- Insuffisance hépatique modérée ou sévère :
L’incidence de l’hyperbilirubinémie de grade 3 ou 4 a été plus élevée chez les patients ayant une insuffisance hépatique modérée avant le traitement (sur la base des données très limitées). De ce fait l’administration de Lonsurf n’est pas recommandée en cas d’insuffisance hépatique modérée ou sévère (selon les critères des groupes C et D du National Cancer Institute (NCI) définis par la bilirubine totale > 1.5 x LSN) avant le début du traitement (voir rubriques 4.4 et 5.2).
Sujets âgés
Aucune modification de la posologie initiale n’est nécessaire pour les patients âgés de 65 ans ou plus (voir rubriques 4.8, 5.1 et 5.2). Les données d’efficacité et de sécurité concernant les patients âgés de plus de 75 ans sont limitées.
Population pédiatrique
Il n’y a pas d’utilisation justifiée de Lonsurf dans la population pédiatrique pour les indications cancer colorectal métastatique (CCRm) et cancer gastrique métastatique (CGm).
Particularités ethniques
Aucune modification de la posologie d’initiation n’est nécessairedu fait del’origine ethnique des patients (voir rubriques 5.1 et 5.2). Les données concernant l’utilisation de Lonsurf chez les patients noirs/Afro-Américains sont limitées mais il n’existe aucune raison, au niveau biologique, de suspecter une différence de réponse dans ce sous-groupe de patients par rapport à la population générale.
Mode d’administration
Voie orale. Les comprimés doivent être pris avec un verre d'eau dans l’heure qui suit la fin des repas du matin et du soir.
4.3 Contre-indications
Hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique 6.1.
4.8 Effets indésirables
Résumé du profil de sécurité
Les effets indésirables les plus graves observés chez les patients recevant Lonsurf sont la myélosuppression et la toxicité gastro-intestinale (voir rubrique 4.4).
Lonsurf en monothérapie
Le profil de sécurité de Lonsurf en monothérapie est basé sur les données agrégées de 1114 patients atteints d’un cancer colorectal ou gastrique métastatiques dans les études cliniques contrôlées de phase III.
Les effets indésirables les plus fréquents (≥30%) sont les neutropénies (53% [34% ≥ Grade 3]), les nausées (31% [1% ≥ Grade 3]), la fatigue (31% [4% ≥ Grade 3]) et l’anémie (30% [11% ≥ Grade 3]).
Les effets indésirables ayant le plus fréquemment (≥ 2%) entrainé l’arrêt du traitement, une réduction de dose, le report ou l’interruption d’une administration sont la neutropénie, l’anémie, la fatigue, la leucopénie, la thrombopénie, la diarrhée et la nausée.
Lonsurf en association au bévacizumab
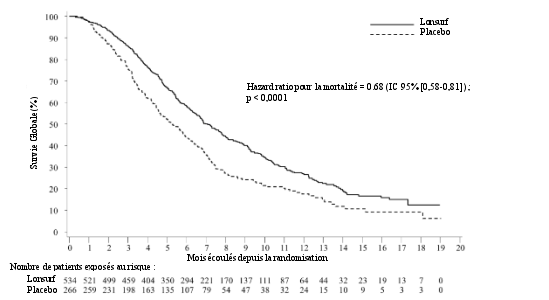
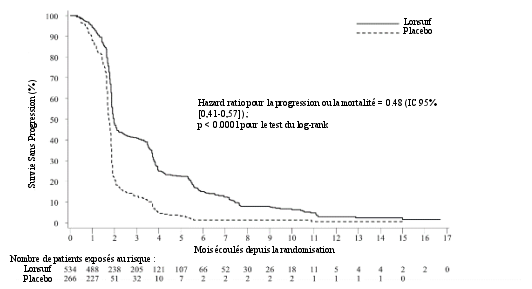
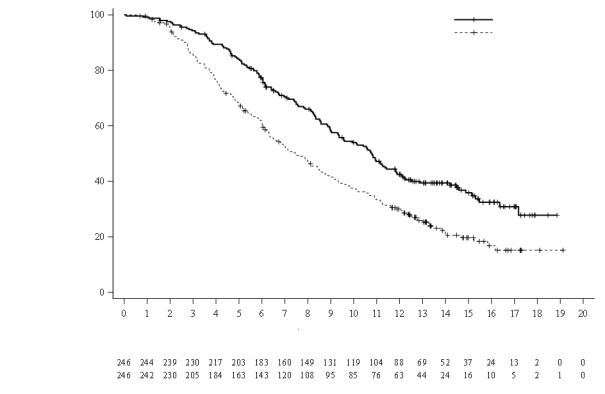
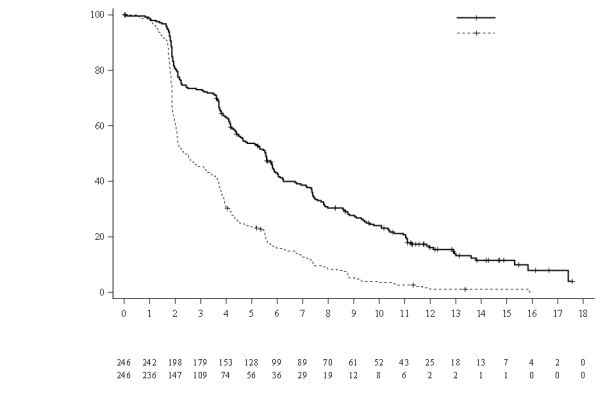
Le profil de sécurité de Lonsurf en association au bévacizumab est basé sur les données de 246 patients atteints d’un cancer colorectal métastatique de l'étude clinique contrôlée de phase III (SUNLIGHT).
Les effets indésirables les plus fréquents (≥ 30 %) sont la neutropénie (69 % [48 % ≥ Grade 3]), la fatigue (35 % [3 % ≥ Grade 3]) et la nausée (33 % [1 % ≥ Grade 3]).
Les effets indésirables ayant le plus fréquemment (≥ 2%) entrainé l’arrêt du traitement, une réduction de dose, le report ou l'interruption d’une administration de Lonsurf lorsqu'il est utilisé en association au bévacizumab ont été la neutropénie, la fatigue, la thrombopénie, la nausée et l'anémie.
Lorsque Lonsurf est utilisé en association au bévacizumab, la fréquence des effets indésirables suivants a augmenté par rapport à Lonsurf en monothérapie : neutropénie (69 % versus 53 %), neutropénie sévère (48 % versus 34 %), thrombopénie (24 % versus 16 %), stomatite (11 % versus 6 %).
Tableau des effets indésirables
Les effets indésirables observés sur 533 patients atteints de cancer colorectal métastatique traités dans le cadre de l’étude clinique de phase III contrôlée versus placebo (RECOURSE), sur 335 patients atteints de cancer gastrique métastatique traités dans le cadre de l’étude clinique de phase III contrôlée versus placebo (TAGS), sur 246 patients traités par Lonsurf en monothérapie et sur 246 patients traités par Lonsurf en association au bévacizumab pour un cancer colorectal métastatique dans l'étude clinique contrôlée de phase III (SUNLIGHT),sont présentés dans le tableau 6. Ils sont présentés par classes de systèmes d’organes (SOC - System Organ Class) et la terminologie MedDRA (Dictionnaire médical des affaires réglementaires liées aux médicaments) appropriée est utilisée pour décrire chaque réaction, ses symptômes, ainsi que les pathologies liées.
Les effets indésirables connus pour Lonsurf administré seul ou avec bévacizumab peuvent survenir lors d'un traitement en association à ces médicaments, même si ces effets n'ont pas été rapportés dans les essais cliniques portant sur le traitement en association.
Les effets indésirables sont regroupés par fréquence. Les groupes de fréquence sont définis sur la base de la convention suivante : très fréquent (≥ 1/10) ; fréquent (≥ 1/100 à < 1/10) ; peu fréquent (≥ 1/1000 à < 1/100) ; et rare (≥ 1/10 000 à < 1/1 000).
Dans chaque groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
Tableau 6 – Effets indésirables rapportés dans les études cliniques chez des patients traités par Lonsurf
System Organ Class (MedDRA)a | Effets indésirables | Fréquence | |
| Monothérapie | Association avec bévacizumab | |
Infections et infestations | Infection des voies respiratoires basses | Fréquent | - |
| Sepsis neutropénique | Peu fréquent | - |
| Infection des voies biliaires | Peu fréquent | - |
| Infection | Peu fréquent | Fréquent |
| Infection urinaire | Peu fréquent | Peu fréquent |
| Infection bactérienne | Peu fréquent | - |
| Infection à Candida | Peu fréquent | - |
| Conjonctivite | Peu fréquent | - |
| Zona | Peu fréquent | - |
| Grippe | Peu fréquent | - |
| Infection des voies respiratoires supérieures | Peu fréquent | - |
| Entérite infectieuse | Rare | - |
| Choc septique b | Rare | - |
| Gingivite | Rare | Peu fréquent |
| Intertrigo inter-orteils (pied d’athlète) | Rare | - |
Tumeurs bénignes, malignes et non précisées (incl kystes et polypes) | Douleur cancéreuse | Peu fréquent | - |
Affections hématologiques et du système lymphatique | Anémie | Très fréquent | Très fréquent |
Neutropénie | Très fréquent | Très fréquent | |
| Leucopénie | Très fréquent | Fréquent |
| Thrombopénie | Très fréquent | Très fréquent |
| Neutropénie fébrile | Fréquent | Peu fréquent |
| Lymphopénie | Fréquent | Fréquent |
| Pancytopénie | Peu fréquent | Peu fréquent |
| Erythropénie | Peu fréquent | - |
| Leucocytose | Peu fréquent | - |
| Monocytopénie | Peu fréquent | - |
| Monocytose | Peu fréquent | - |
| Granulocytopénie | Rare | - |
Troubles du métabolisme et de la nutrition | Diminution de l’appétit | Très fréquent | Très fréquent |
Hypoalbuminémie | Fréquent | Peu fréquent | |
| Déshydratation | Peu fréquen | - |
| Hyperglycémie | Peu fréquent | Peu fréquent |
| Hyperkaliémie | Peu fréquent | - |
| Hypocalcémie | Peu fréquent | - |
| Hypokaliémie | Peu fréquent | - |
| Hyponatrémie | Peu fréquent | - |
| Hypophosphatémie | Peu fréquent | - |
| Goutte | Rare | - |
| Hypernatrémie | Rare | - |
Affections psychiatriques | Anxiété | Peu fréquent | - |
| Insomnie | Peu fréquent | - |
Affections du système nerveux | Dysgueusie | Fréquent | Fréquent |
| Sensation vertigineuse | Peu fréquent | Fréquent |
| Céphalées | Peu fréquent | Fréquent |
| Neuropathie périphérique | Peu fréquent | Peu fréquent |
| Paresthésie | Peu fréquent | Peu fréquent |
| Léthargie | Peu fréquent | - |
| Neurotoxicité | Peu fréquent | - |
| Sensation de brûlure | Rare | - |
| Dysesthésie | Rare | - |
| Hyperesthésie | Rare | - |
| Hypoesthésie | Rare | - |
| Syncope | Rare | - |
Affections oculaires | Cataracte | Rare | - |
| Diplopie | Rare | - |
| Sècheresse oculaire | Rare | - |
| Vision floue | Rare | - |
| Baisse de l’acuité visuelle | Rare | - |
Affections de l’oreille et du labyrinthe | Vertige | Peu fréquent | - |
| Inconfort auditif | Rare | - |
Affections cardiaques | Angine de poitrine | Peu fréquent | - |
| Arythmie | Peu fréquent | - |
| Palpitations | Peu fréquent | - |
Affections vasculaires | Hypertension | Peu fréquent | Fréquent |
| Bouffée congestive | Peu fréquent | - |
| Hypotension | Peu fréquent | - |
| Embolie | Rare | - |
Affections respiratoires, thoraciques et médiastinales | Dyspnée | Fréquent | Fréquent |
Embolie pulmonaire b | Peu fréquent | - | |
| Dysphonie | Peu fréquent | Peu fréquent |
| Toux | Peu fréquent | - |
| Épistaxis | Peu fréquent | - |
| Rhinorrhée | Rare | Peu fréquent |
| Douleur oropharyngée | Rare | - |
| Épanchement pleural | Rare | - |
Affections gastro-intestinales | Diarrhées | Très fréquent | Très fréquent |
| Vomissements | Très fréquent | Très fréquent |
| Nausées | Très fréquent | Très fréquent |
| Douleur abdominale | Fréquent | Fréquent |
| Stomatite | Fréquent | Très fréquent |
| Constipation | Fréquent | Fréquent |
| Iléus | Peu fréquent | - |
| Hémorragie gastro-intestinale | Peu fréquent | - |
| Colite | Peu fréquent | Peu fréquent |
| Ulcération de la bouche | Peu fréquent | Fréquent |
| Affections buccales | Peu fréquent | Fréquent |
| Distension abdominale | Peu fréquent | Peu fréquent |
| Inflammation anale | Peu fréquent | Peu fréquent |
| Dyspepsie | Peu fréquent | Peu fréquent |
| Flatulences | Peu fréquent | Peu fréquent |
| Gastrite | Peu fréquent | - |
| Reflux gastro-œsophagien | Peu fréquent | - |
| Glossite | Peu fréquent | - |
| Perturbations de la vidange gastrique | Peu fréquent | - |
| « Haut-le-cœur » | Peu fréquent | - |
| Affections dentaires | Peu fréquent | - |
| Ascite | Rare | - |
| Pancréatite aiguë | Rare | - |
| Subiléus | Rare | - |
| Mauvaise haleine | Rare | - |
| Polype buccal | Rare | - |
| Entérocolite hémorragique | Rare | - |
| Saignement gingival | Rare | - |
| Œsophagite | Rare | - |
| Maladies parodontales | Rare | - |
| Proctalgie | Rare | - |
| Reflux gastrique | Rare | - |
Affections hépatobiliaires | Hyperbilirubinémie | Fréquent | Fréquent |
| Hépatotoxicité | Peu fréquent | - |
| Dilatation biliaire | Rare | - |
Affections de la peau et du tissu sous-cutané | Alopécie | Fréquent | Fréquent |
Sècheresse cutanée | Fréquent | Fréquent | |
| Prurit | Fréquent | Peu fréquent |
| Rash | Fréquent | Peu fréquent |
| Onychopathies | Peu fréquent | Peu fréquent |
| Erythrodysesthésie palmo-plantaire c | Peu fréquent | Peu fréquent |
| Acné | Peu fréquent | - |
| Hyperhidrose | Peu fréquent | - |
| Urticaire | Peu fréquent | - |
| Cloques | Rare | - |
| Érythème | Rare | - |
| Réactions de photosensibilité | Rare | - |
| Exfoliation cutanée | Rare | - |
Affections musculo-squelettiques et systémiques | Arthralgie | Peu fréquent | Fréquent |
Myalgie | Peu fréquent | Fréquent | |
| Faiblesse musculaire | Peu fréquent | Peu fréquent |
| Douleurs des extrémités | Peu fréquent | Peu fréquent |
| Douleurs osseuses | Peu fréquent | - |
| Douleurs musculosquelettiques | Peu fréquent | - |
| Spasmes musculaires | Peu fréquent | - |
| Gonflement des articulations | Rare | - |
Affections du rein et des voies urinaires | Protéinurie | Fréquent | Peu fréquent |
| Insuffisance rénale | Peu fréquent | - |
| Hématurie | Peu fréquent | - |
| Troubles mictionnels | Peu fréquent | - |
| Cystite non infectieuse | Rare | - |
| Leucocyturie | Rare | - |
Affections des organes de reproduction et du sein | Troubles menstruels | Rare | Peu fréquent |
Troubles généraux et anomalies au site d'administration | Fatigue | Très fréquent | Très fréquent |
Fièvre | Fréquent | Peu fréquent | |
| Inflammation des muqueuses | Fréquent | Peu fréquent |
| Malaise | Fréquent | - |
| Œdème | Fréquent | - |
| Altération de l’état général | Peu fréquent | - |
| Douleur | Peu fréquent | Peu fréquent |
| Sensation de variation de la température corporelle | Peu fréquent | - |
| Xérose | Rare | - |
Investigations | Perte de poids | Fréquent | Fréquent |
| Elévation des enzymes hépatiques | Fréquent | Fréquent |
| Elévation de la Phosphatase alcaline sanguine | Fréquent | Peu fréquent |
| Elévation de la lactate déshydrogénase sanguine | Peu fréquent | - |
| Elévation de la protéine C réactive | Peu fréquent | - |
| Elévation de la créatininémie | Peu fréquent | - |
| Elévation de l’urémie | Peu fréquent | - |
| Diminution de l’hématocrite | Peu fréquent | - |
| Elévation de l’INR | Peu fréquent | - |
| Augmentation du temps de thromboplastine partielle activée (aPTT) | Rare | - |
| Allongement de l’intervalle QT à l’ECG | Rare | - |
| Diminution des protéines totales | Rare | - |
a Différents termes MedDRA considérés comme cliniquement similaires ont été regroupés en un seul terme.
b Des cas de décès ont été rapportés.
c Syndrome main-pied.
Population âgée
Les patients de 65 ans et plus traités par Lonsurf en monothérapie ont présenté une incidence (≥ 5%) plus élevée des évènements indésirables reliés au traitement suivants, comparativement aux patients de moins de 65 ans : neutropénie (58,9 % versus 48,2 %), neutropénie sévère (41,3 % versus 27,9 %), anémie (36,5 % versus 25,2 %), anémie sévère (14,1 % versus 8,9 %), diminution de l'appétit (22,6 % versus 17,4 %) et thrombopénie (21,4 % versus 12,1 %).
Lorsque Lonsurf est utilisé en association au bévacizumab, les patients âgés de 65 ans ou plus ont présenté une incidence plus élevée (≥ 5 %) des évènements indésirables reliés au traitement comparativement aux patients de moins de 65 ans : neutropénie (75,0 % versus 65,1 %), neutropénie sévère (57,0 % versus 41,8 %), fatigue (39,0 % versus 32,2 %), thrombopénie (28,0 % versus 20,5 %) et stomatite (14,0 % versus 8,9 %).
Infections
Dans les études de phase III contrôlées versus placebo, des infections reliées au traitement sont plus fréquemment survenues chez les patients traités par Lonsurf (5,8%) que chez les patients ayant reçu le placebo (1,8%).
Dans l'étude clinique en association au bévacizumab, des infections liées au traitement sont survenues de manière similaire chez les patients ayant reçu Lonsurf en association au bévacizumab (2,8 %) comparativement aux patients traités par Lonsurf (2,4 %).
Protéinurie
Dans les études de phase III contrôlées versus placebo, la survenue d’une protéinurie reliée au traitement a été plus fréquente dans le groupe de patients traités par Lonsurf (1,8%) comparativement au taux relevé chez ceux ayant reçu le placebo (0,9%). En termes de sévérité, il s’agissait pour tous ces cas de protéinuries de Grade 1 ou 2 (voir rubrique 4.4).
Dans l'étude clinique en association au bévacizumab, un patient ayant reçu Lonsurf en association au bévacizumab (0,4 %) a rapporté une protéinurie reliée au traitement, qui était de grade 2, et aucune dans le groupe de patients traités par Lonsurf (voir rubrique 4.4).
Radiothérapie
Dans l’étude RECOURSE, l’incidence de survenue des effets indésirables hématologiques et liés à la myélosuppression a été légèrement plus importante chez les patients ayant préalablement été traités par radiothérapie (54,6 %), comparativement à celle constatée chez les patients n’en ayant préalablement pas reçue (49,2 %). Il convient de remarquer que l’incidence de survenue de neutropénies fébriles était plus importante chez les patients traités par Lonsurf et préalablement traités par radiothérapie que chez les patients n’en ayant préalablement pas reçue.
Dans l'étude clinique en association au bévacizumab, aucune augmentation de l'incidence des effets indésirables hématologiques ou liés à la myélosuppression n'a été observée chez les patients ayant préalablement été traités par radiothérapie comparativement aux patients sans radiothérapie préalable dans les deux groupes de traitement de SUNLIGHT : Lonsurf avec bévacizumab (73,7 % versus 77,4 %) et dans le groupe de patients traités par Lonsurf (64,7 % versus 67,7 %).
Expérience post-commercialisation chez des patients atteints de cancers colorectaux avancés inopérables ou récurrents
Des cas de pneumopathie interstitielle diffuse ont été rapportés en post-commercialisation chez des patients traités par Lonsurf.
Déclaration des effets indésirables suspectés
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration:
Belgique
Agence fédérale des médicaments et des produits de santé
www.afmps.be
Division Vigilance
Site internet : www.notifieruneffetindesirable.be
E-mail : adr@fagg-afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy
ou Division de la pharmacie et des médicaments
de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHÉ
Les Laboratoires Servier
50 rue Carnot
92284 Suresnes Cedex
France
8. NUMÉRO(S) D’AUTORISATION DE MISE SUR LE MARCHÉ
EU/1/16/1096/001-006
10. DATE DE MISE À JOUR DU TEXTE
07/2023
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments http://www.ema.europa.eu/ et sur le site internet de l’ANSM http://ansm.sante.fr/.
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 3434818 | LONSURF 15MG/6,14MG COMP PELL 20 | L01BC59 | - | € 575 | Oui | - | - |
| 3434883 | LONSURF 20MG/8,19MG COMP PELL 20 | L01BC59 | - | € 766,67 | Oui | - | - |