1. DÉNOMINATION DU MÉDICAMENT
NovoMix 50 Penfill 100 unités/ml, suspension injectable en cartouche
NovoMix 50 FlexPen 100 unités/ml, suspension injectable en stylo prérempli
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
NovoMix 50 Penfill
1 ml de suspension contient 100 unités d’insuline asparte* soluble/insuline asparte* protamine cristallisée dans un rapport de 50/50 (soit 3,5 mg). 1 cartouche contient 3 ml soit 300 unités.
NovoMix 50 FlexPen
1 ml de suspension contient 100 unités d’insuline asparte* soluble/insuline asparte* protamine cristallisée dans un rapport de 50/50 (soit 3,5 mg). 1 stylo prérempli contient 3 ml soit 300 unités.
* L’insuline asparte est produite sur Saccharomyces cerevisiae par la technique de l’ADN recombinant.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Suspension injectable.
La suspension est opaque, blanche et aqueuse.
4. INFORMATIONS CLINIQUES
4.1 Indications thérapeutiques
NovoMix 50 est indiqué dans le traitement du diabète de l’adulte.
4.2 Posologie et mode d’administration
Posologie
La teneur en insuline des analogues de l’insuline, y compris l’insuline asparte, est exprimée en unités, alors que la teneur en insuline de l’insuline humaine est exprimée en unités internationales.
La posologie de NovoMix 50 dépend de chaque individu et est determinée en fonction des besoins du patient. Un contrôle glycémique et un ajustement de la dose de l’insuline sont recommandés afin d’obtenir un équilibre glycémique optimal.
Les besoins individuels en insuline se situent généralement entre 0,5 et 1,0 unité/kg/jour. Ces besoins peuvent être couverts en partie ou en totalité par NovoMix 50.
Chez les patients diabétiques de type 2, NovoMix 50 peut être administré seul ou en association avec la metformine lorsque la glycémie est insuffisamment contrôlée par la metformine seule.
Un ajustement de la dose peut être nécessaire si le patient augmente son activité physique, modifie son régime alimentaire habituel ou en cas de maladie concomitante.
Populations particulières
Il est nécessaire d’intensifier le contrôle glycémique et d’ajuster la dose de l’insuline asparte de façon individuelle chez les patients âgés (≥ 65 ans) et chez les patients atteints de troubles rénaux ou hépatiques.
Les troubles rénaux ou hépatiques peuvent réduire les besoins du patient en insuline.
Population pédiatrique
La sécurité et l’efficacité de NovoMix 50 chez les enfants âgés de moins de 18 ans n’ont pas été établies.
Aucune donnée n’est disponible.
En remplacement d’autres insulines
Le remplacement d’une insuline par NovoMix 50 peut nécessiter une adaptation de la dose et des horaires d’administration. Il est recommandé de surveiller attentivement la glycémie lors du changement de traitement et durant les premières semaines (voir rubrique 4.4).
Mode d’administration
NovoMix 50 est une suspension biphasique d’analogue de l’insuline, l’insuline asparte. La suspension contient de l’insuline asparte à action rapide et à action intermédiaire dans un rapport de 50/50.
NovoMix 50 doit être administré par voie sous-cutanée uniquement.
NovoMix 50 doit être administré par voie sous-cutanée dans la cuisse ou la paroi abdominale. Si besoin, la région fessière ou deltoïde peuvent être utilisées. Une rotation des sites d’injection au sein d’une même région devra toujours être effectuée afin de diminuer le risque de développer une lipodystrophie et une amyloïdose cutanée (voir rubriques 4.4 et 4.8). L’influence des différents sites d’injection sur l’absorption de NovoMix 50 n’a pas été étudiée. La durée d’action varie en fonction de la dose, du site d’injection, du débit sanguin, de la température et de l’intensité de l’activité physique.
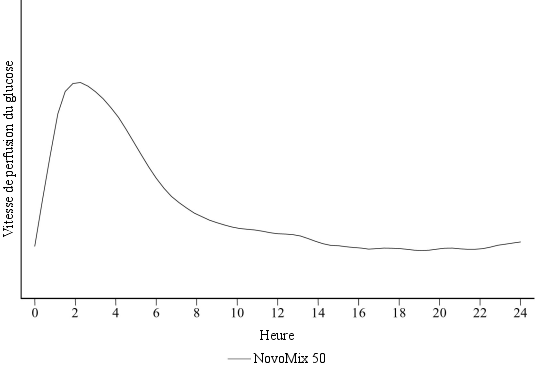
NovoMix 50 a un délai d’action plus rapide que l’insuline humaine biphasique et doit généralement être administré immédiatement avant un repas. Si nécessaire, NovoMix 50 peut être injecté peu après un repas.
Pour des instructions d’utilisation plus détaillées, veuillez vous référer à la notice.
NovoMix 50 Penfill
Administration avec un système d’administration d’insuline
NovoMix 50 Penfill est conçu pour être utilisé avec les systèmes d’administration d’insuline Novo Nordisk et les aiguilles NovoFine ou NovoTwist. NovoMix 50 Penfill ne convient que pour les injections sous-cutanées administrées au moyen d’un stylo réutilisable. Si une administration au moyen d’une seringue, est nécessaire, il convient d’utiliser un flacon.
NovoMix 50 FlexPen
Administration avec FlexPen
NovoMix 50 FlexPen est un stylo prérempli (avec un code couleur) conçu pour être utilisé avec les aiguilles NovoFine ou NovoTwist. FlexPen permet d’injecter 1 à 60 unités par paliers de 1 unité. NovoMix 50 FlexPen ne convient que pour les injections sous-cutanées. Si une administration au moyen d’une seringue, est nécessaire, il convient d’utiliser un flacon.
4.3 Contre-indications
Hypersensibilité à la substance active ou à l'un des excipients mentionnés à la rubrique 6.1.
4.8 Effets indésirables
Résumé du profil de sécurité
Les effets indésirables observés chez les patients traités par NovoMix sont le plus souvent dus à l’action pharmacologique de l’insuline asparte.
L’effet indésirable le plus fréquemment rapporté lors du traitement est l’hypoglycémie. La fréquence des hypoglycémies varie en fonction de la population de patients, des doses utilisées et du niveau du contrôle glycémique, voir Description de certains effets indésirables ci-dessous.
Au début du traitement par insuline, des anomalies de la réfraction, des œdèmes et des réactions au site d’injection (douleur, rougeur, urticaire, inflammation, ecchymose, tuméfaction et prurit au site d’injection) peuvent survenir. Ces réactions sont habituellement transitoires. Une amélioration rapide de l’équilibre glycémique peut être associée à une neuropathie douloureuse aiguë qui est habituellement réversible. Une intensification de l’insulinothérapie avec une amélioration soudaine de l’équilibre glycémique peut être associée à une aggravation transitoire de la rétinopathie diabétique, tandis que l’amélioration de l’équilibre glycémique à long terme diminue le risque de progression de la rétinopathie diabétique.
Liste tabulée des effets indésirables
Les effets indésirables répertoriés ci-dessous sont issus des données des essais cliniques et classés par fréquence MedDRA et selon le système de classification par organe. Les catégories de fréquence sont définies selon les conventions suivantes : très fréquent (≥ 1/10) ; fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1 000, < 1/100) ; rare (≥ 1/10 000, < 1/1 000) ; très rare (< 1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Affections du système immunitaire | Peu fréquent – Urticaire, rash, éruptions |
Très rare – Réactions anaphylactiques* | |
Troubles du métabolisme et de la nutrition | Très fréquent – Hypoglycémie* |
Affections du système nerveux | Rare – Neuropathie périphérique (neuropathie douloureuse) |
Affections oculaires | Peu fréquent – Anomalies de la réfraction |
Peu fréquent – Rétinopathie diabétique | |
Affections de la peau et du tissu sous-cutané | Peu fréquent – Lipodystrophie* |
Fréquence indéterminée – Amyloïdose cutanée*† | |
Troubles généraux et anomalies au site d’administration | Peu fréquent – Œdème |
Peu fréquent – Réactions au site d’injection |
* voir Description de certains effets indésirables
† EI provenant de données après commercialisation.
Description de certains effets indésirables
Réactions anaphylactiques :
La survenue de réactions d’hypersensibilité généralisée (notamment des éruptions cutanées généralisées, prurit, sueurs, troubles gastro-intestinaux, œdème angioneurotique, difficultés respiratoires, palpitations et baisse de la pression artérielle) est très rare mais ces réactions peuvent potentiellement menacer le pronostic vital.
Hypoglycémie :
L’effet indésirable le plus fréquemment rapporté est l’hypoglycémie. Celle-ci survient lorsque la dose d’insuline est trop importante par rapport aux besoins insuliniques. L’hypoglycémie sévère peut entraîner une perte de connaissance et/ou des convulsions et peut causer une altération transitoire ou définitive des fonctions cérébrales, voire le décès. Les symptômes de l’hypoglycémie surviennent habituellement de manière soudaine. Ils peuvent inclure : sueurs froides, pâleur et froideur cutanées, fatigue, nervosité ou tremblement, anxiété, asthénie ou faiblesse inhabituelles, confusion, difficulté de concentration, somnolence, sensation de faim excessive, troubles visuels, maux de tête, nausées et palpitations.
Lors des essais cliniques, la fréquence des hypoglycémies a varié en fonction de la population de patients, des doses utilisées et du niveau du contrôle glycémique. Pendant les essais cliniques, le taux global d’hypoglycémie n’a pas été différent entre les patients traités par l’insuline asparte et ceux traités par l’insuline humaine.
Affections de la peau et du tissu sous-cutané :
La lipodystrophie (notamment la lipohypertrophie, la lipoatrophie) et l’amyloïdose cutanée peuvent survenir au niveau du site d'injection et retarder l’absorption locale de l’insuline. Une rotation continue des sites d’injection dans une zone donnée peut aider à diminuer ou éviter ces réactions (voir rubrique 4.4).
Population pédiatrique
La sécurité et l’efficacité de NovoMix 50 chez les enfants âgés de moins de 18 ans n’ont pas été établies. Aucune donnée n’est disponible.
Autres populations particulières
Depuis la mise sur le marché et lors des essais cliniques, la fréquence, le type et la sévérité des effets indésirables observés chez les patients âgés et chez les patients atteints de troubles rénaux ou hépatiques ne montrent pas de différences avec une plus grande expérience acquise dans la population générale.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration :
Belgique
Agence fédérale des médicaments et des produits de santé
Division Vigilance
Boîte Postale 97
B-1000 Bruxelles Madou
Site internet : www.notifieruneffetindesirable.be
e-mail : adr@afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy ou Division de la pharmacie et des médicaments de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHÉ
Novo Nordisk A/S
Novo Allé
DK-2880 Bagsværd
Danemark
8. NUMÉROS D’AUTORISATION DE MISE SUR LE MARCHÉ
NovoMix 50 Penfill
EU/1/00/142/011
EU/1/00/142/012
EU/1/00/142/013
NovoMix 50 FlexPen
EU/1/00/142/014
EU/1/00/142/015
EU/1/00/142/016
10. DATE DE MISE À JOUR DU TEXTE
05/2023
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments http://www.ema.europa.eu.
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 2454726 | NOVOMIX 50 PENFILL 100U/1ML 5 3ML | A10AD05 | € 36,11 | - | Oui | - | - |
| 2824167 | NOVOMIX 50 FLEXPEN SUSP INJ STYLO PREREMPLI 5 | A10AD05 | € 41,2 | - | Oui | - | - |