RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
1. DÉNOMINATION DU MÉDICAMENT
Relvar Ellipta 92 microgrammes/22 microgrammes poudre pour inhalation, en récipient unidose
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque inhalation délivre une dose (au niveau de l'embout buccal) de 92 microgrammes de furoate de fluticasone et 22 microgrammes de vilantérol (sous forme de trifénatate) ce qui correspond à une dose contenue dans chaque récipient unidose de 100 microgrammes de furoate de fluticasone et 25 microgrammes de vilantérol (sous forme de trifénatate).
Excipient à effet notoire
Chaque dose délivrée contient approximativement 25 mg de lactose monohydraté.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Poudre pour inhalation, en récipient unidose
Poudre blanche dans un inhalateur gris clair (Ellipta) avec un couvercle jaune et un compteur de doses.
4. INFORMATIONS CLINIQUES
4.1 Indications thérapeutiques
Asthme
Relvar Ellipta est indiqué en traitement continu de l'asthme chez les adultes et les adolescents âgés de 12 ans et plus, dans les situations où l’utilisation d'un médicament associant un corticoïde par voie inhalée et un bronchodilatateur bêta2-agoniste de longue durée d'action est justifiée :
- chez des patients insuffisamment contrôlés par une corticothérapie inhalée et la prise d'un bronchodilatateur bêta2-agoniste à action rapide et de courte durée par voie inhalée "à la demande",
- chez les patients contrôlés par l'administration d'une corticothérapie inhalée associée à un traitement continu par bêta-2 agoniste de longue durée d'action par voie inhalée.
Bronchopneumopathie chronique obstructive (BPCO)
Relvar Ellipta est indiqué en traitement symptomatique de la BPCO chez les adultes dont le VEMS (mesuré après administration d'un bronchodilatateur) est inférieur à 70 % de la valeur théorique et ayant des antécédents d'exacerbations malgré un traitement bronchodilatateur continu.
4.2 Posologie et mode d’administration
Posologie
Asthme
Chez les patients asthmatiques, il convient d'utiliser le dosage de Relvar Ellipta contenant la dose de furoate de fluticasone (FF) appropriée à la sévérité de leur maladie. Dans l'asthme, le furoate de fluticasone (FF) 100 microgrammes une fois par jour est approximativement équivalent au propionate de fluticasone (FP) 250 microgrammes deux fois par jour tandis que le FF 200 microgrammes une fois par jour est approximativement équivalent au FP 500 microgrammes deux fois par jour.
Adultes et adolescents de 12 ans et plus
Une dose initiale d’une inhalation de 92/22 microgrammes de Relvar Ellipta une fois par jour doit être envisagée pour les adultes et les adolescents âgés de 12 ans et plus ayant besoin de doses faibles à moyennes de corticoïdes inhalés associées à un bronchodilatateur bêta2-agoniste de longue durée d'action par voie inhalée.
Si cette dose apparaît insuffisante pour le contrôle de l'asthme, la dose peut être augmentée à 184/22 microgrammes ce qui pourrait améliorer le contrôle de l’asthme.
Les patients doivent être régulièrement évalués par un professionnel de santé afin de s’assurer que le dosage de furoate de fluticasone/vilantérol qu’ils reçoivent reste optimal. Il ne sera modifié que sur avis médical. Il convient de toujours rechercher la posologie minimale efficace avec laquelle le contrôle des symptômes est maintenu.
Relvar Ellipta 184/22 microgrammes doit être envisagé pour les adultes et les adolescents âgés de 12 ans et plus ayant besoin d'une dose plus élevée de corticoïde inhalé associée à un bronchodilatateur bêta2-agoniste de longue durée d'action par voie inhalée.
Généralement, les patients ressentent une amélioration de leur fonction respiratoire dans les 15 minutes qui suivent l'inhalation de Relvar Ellipta.
Cependant, il conviendra de les informer qu’une utilisation quotidienne est nécessaire pour contrôler les symptômes de l’asthme et que le traitement doit être poursuivi même en cas de disparition des symptômes.
Si les symptômes surviennent entre les prises, un bronchodilatateur bêta2-agoniste à action rapide et de courte durée par voie inhalée doit être utilisé pour obtenir un soulagement immédiat.
Enfants de moins de 12 ans
La sécurité et l’efficacité de Relvar Ellipta chez les enfants âgés de moins de 12 ans n’ont pas été établies dans l’asthme.
Relvar Ellipta ne doit pas être utilisé chez les enfants âgés de moins de 12 ans. Les données actuellement disponibles sont décrites dans les rubriques 5.1 et 5.2.
BPCO
Adultes âgés de 18 ans et plus
Une inhalation de Relvar Ellipta 92/22 microgrammes une fois par jour.
Relvar Ellipta 184/22 microgrammes n'est pas indiqué chez les patients atteints de BPCO. Relvar Ellipta 184/22 microgrammes n’apporte aucun bénéfice supplémentaire par rapport à Relvar Ellipta 92/22 microgrammes dans la BPCO alors qu'il existe un risque potentiel accru de pneumonie et d’effets indésirables systémiques liés aux corticoïdes (voir rubriques 4.4 et 4.8).
Généralement, les patients ressentent une amélioration de leur fonction respiratoire dans les 16 à 17 minutes suivant l'inhalation de Relvar Ellipta.
Population pédiatrique
Il n’existe pas d’utilisation justifiée de Relvar Ellipta dans la population pédiatrique (âgée de moins de 18 ans) pour l’indication BPCO.
Populations spécifiques
Patients âgés
Aucune adaptation posologique n’est nécessaire chez les patients âgés de 65 ans ou plus (voir rubrique 5.2).
Insuffisance rénale
Aucune adaptation posologique n’est nécessaire dans cette population (voir rubrique 5.2).
Insuffisance hépatique
Des études menées chez les sujets présentant une insuffisance hépatique légère, modérée et sévère ont montré une augmentation de l'exposition systémique au furoate de fluticasone (à la fois de la Cmax et de l'ASC) (voir rubrique 5.2).
La prudence est recommandée chez les patients présentant une insuffisance hépatique en raison du risque plus important d'effets indésirables systémiques liés aux corticoïdes dans cette population.
Chez les patients présentant une insuffisance hépatique modérée ou sévère, la dose maximale est de 92/22 microgrammes (voir rubrique 4.4).
Mode d’administration
Relvar Ellipta s’administre par voie inhalée uniquement.
Il doit être administré chaque jour au même moment de la journée.
La décision du moment de la prise, matin ou soir, est laissée à l'appréciation du médecin.
Après inhalation, les patients doivent se rincer la bouche avec de l'eau sans l’avaler.
En cas d'oubli d'une prise, la dose suivante doit être prise à l'heure habituelle le lendemain.
Si l’inhalateur est conservé dans un réfrigérateur, il doit rester pendant au moins une heure à température ambiante avant d’être utilisé.
Lors de la première utilisation de l’inhalateur, il n’est pas nécessaire de vérifier au préalable le bon fonctionnement du dispositif et il n’y a pas de manipulation particulière à réaliser. Les instructions doivent être suivies étape par étape.
L’inhalateur Ellipta est conditionné dans une barquette contenant un sachet dessiccant pour réduire l'humidité. Le sachet dessiccant doit être jeté, il ne doit ni être ouvert, ni avalé, ni inhalé.
Le patient devra être informé qu’il ne doit sortir son inhalateur de sa barquette que lorsqu’il est prêt à débuter son traitement.
Lorsque l'inhalateur est sorti de sa barquette, il est en position «fermé». La date à laquelle l’inhalateur doit être éliminé doit être inscrite sur l'étiquette de l'inhalateur dans l'espace prévu à cet effet. La date à laquelle l’inhalateur doit être éliminé est de 6 semaines à compter de la date d’ouverture de la barquette. Après cette date, l'inhalateur ne doit plus être utilisé. La barquette peut être éliminée après la première ouverture.
Les instructions étape par étape de l’inhalateur Ellipta 30 doses (quantité pour 30 jours) ci-dessous s'appliquent également à l’inhalateur Ellipta 14 doses (quantité pour 14 jours).
Instruction d’utilisation
- A lire avant de prendre ce médicament
Si le couvercle de l’inhalateur Ellipta est ouvert puis refermé sans inhaler le médicament, la dose sera perdue. La dose perdue sera maintenue à l'intérieur de l'inhalateur, mais ne sera plus disponible pour l’inhalation.
Il est impossible de prendre accidentellement trop de médicament ou une dose double en une seule inhalation.


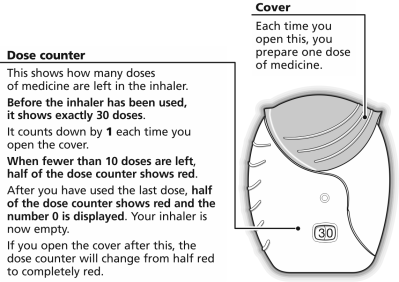
- Préparer une dose
Le couvercle ne sera ouvert que lorsque le patient est prêt à inhaler une dose. Ne pas secouer l’inhalateur.
Faire glisser le couvercle vers le bas jusqu'à ce qu’un «clic» soit entendu. Le médicament est maintenant prêt à être inhalé.
Le compteur de doses affiche 1 dose en moins pour le confirmer. Si l'inhalateur ne commence pas le décompte des doses dès que le «clic» a été entendu, il ne délivrera pas de dose et il faut le rapporter au pharmacien.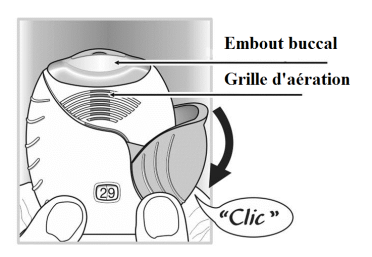
- Comment inhaler le médicament
Tenir l’inhalateur loin de la bouche et expirer aussi longuement que possible.
Ne pas expirer dans l'inhalateur.
L'embout buccal doit être placé entre les lèvres et les lèvres doivent être serrées fermement autour de l'embout buccal. Veiller à ne pas obstruer la grille d’aération avec les doigts pendant l’utilisation.
- Inhaler avec une inspiration longue, profonde et régulière. Maintenir cette inspiration le plus longtemps possible (pendant au moins 3-4 secondes).
- Retirer l'inhalateur de la bouche.
- Expirer lentement et doucement.

Il est possible de ne pas sentir ni le produit ni son goût alors que l’inhalateur a été correctement utilisé.
L'embout buccal peut être nettoyé à l'aide d'un chiffon sec avant de fermer le couvercle.
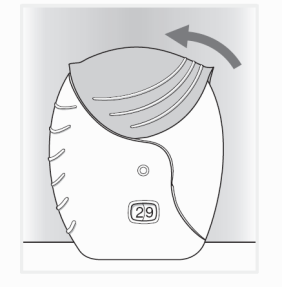
- Fermer l’inhalateur et rincer la bouche
Faire glisser le couvercle vers le haut jusqu’à ce qu’il couvre l'embout buccal.
Rincer la bouche après avoir utilisé l'inhalateur, n’avalez pas.
Cela permettra de réduire la probabilité de développer des effets indésirables comme une irritation/douleur de la bouche ou de la gorge.
4.3 Contre-indications
Hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique 6.1.
4.8 Effets indésirables
Résumé du profil de sécurité
La fréquence des effets indésirables associés au furoate de fluticasone/vilantérol a été déterminée sur les données issues d’un large programme clinique dans l’asthme et la BPCO. Dans le programme de développement clinique dans l'asthme, un total de 7 034 patients a été considéré pour l’analyse regroupée des effets indésirables. Dans le programme de développement clinique dans la BPCO, un total de 6 237 sujets a été considéré pour l’analyse regroupée des effets indésirables.
Les effets indésirables les plus fréquemment rapportés avec le furoate de fluticasone et vilantérol étaient les céphalées et les rhinopharyngites. À l'exception des pneumonies et des fractures, le profil de tolérance était semblable chez les patients présentant un asthme ou une BPCO. Au cours des études cliniques, les pneumonies et les fractures osseuses étaient plus fréquemment observées chez les patients présentant une BPCO.
Liste tabulée des effets indésirables
Les effets secondaires sont listés par classe de système d’organes et par fréquence. La convention suivante a été utilisée pour la classification des fréquences de survenue : très fréquent (1/10), fréquent (1/100 et 1/10), peu fréquent (1/1 000 et 1/100), rare (1/10 000 et 1/1 000) et très rare (<1/10 000).
Dans chaque groupe de fréquence, les effets indésirables sont présentés dans un ordre décroissant de gravité.
Classe organe | Effet(s) indésirable(s) | Fréquence |
Infections et Infestations | Pneumonie* | Fréquent |
Troubles du système immunitaire | Réactions d'hypersensibilité incluant anaphylaxie, angioedème, éruption et urticaire. | Rare |
Troubles du métabolisme et de la nutrition | Hyperglycémie | Peu fréquent |
Troubles psychiatriques | Anxiété | Rare |
Troubles du système nerveux | Céphalée | Très fréquent |
Troubles oculaires | Vision floue (voir rubrique 4.4) | Peu fréquent |
Troubles cardiaques | Extrasystoles | Peu fréquent |
Troubles respiratoires, thoraciques et médiastinaux | Rhinopharyngite | Très fréquent |
Troubles gastro-intestinaux | Douleur abdominale | Fréquent |
Troubles musculo-squelettiques et systémiques | Arthralgie | Fréquent |
Troubles généraux et anomalie au site d’administration | Fièvre | Fréquent |
*, ** voir ci-dessous la description des effets indésirables sélectionnés
Description des effets indésirables sélectionnés
*Pneumonie (voir rubrique 4.4)
Dans une analyse groupée de deux études menées sur 1 an chez des patients présentant une BPCO modérée à sévère (à la sélection, VEMS moyen après l’administration d’un bronchodilatateur de 45% de la valeur théorique, écart-type (DS) de 13%) ayant eu un épisode d’exacerbation de BPCO l'année précédente (n = 3255), le nombre de pneumonies était de 97,9/1000 patient-années dans le groupe FF/VI 184/22 microgrammes, de 85,7/1000 patient-années dans le groupe FF/VI 92/22 microgrammes et de 42,3/1000 patient-années dans le groupe VI 22 microgrammes. Pour les pneumonies sévères, le nombre d’événements correspondant dans chacun des groupes était respectivement de 33,6/1000 patient-années, 35,5/1000 patient-années et 7,6/1000 patient-années alors que pour les pneumonies graves il était de 35,1/1000 patient-années dans le groupe FF/VI 184/22 microgrammes, de 42,9/1000 patient-années dans le groupe FF/VI 92/22 microgrammes, et de 12,1/1000 patient-années dans le groupe VI 22 microgrammes. Enfin, les cas mortels de pneumonie ajustés à l’exposition étaient de 8,8 dans le groupe FF/VI 184/22 microgrammes contre 1,5 dans le groupe FF/VI 92/22 microgrammes et 0 dans le groupe VI 22 microgrammes.
Dans une étude contrôlée contre placebo (SUMMIT) chez des sujets présentant une BPCO modérée (à la sélection, VEMS moyen après l’administration d’un bronchodilatateur de 60% de la valeur prédite, déviation standard : 6%), et ayant des antécédents ou des facteurs de risque cardiovasculaires, l’incidence des pneumonies avec FF/VI, FF, VI et placebo était : évènements indésirables (6%, 5%, 4%, 5%) ; évènements indésirables graves (3%, 4%, 3%, 3%) ; décès imputables au traitement en relation avec la survenue de pneumonies (0,3%, 0,2%, 0,1%, 0,2%) ; les taux ajustés en fonction de l’exposition (pour 1000 traitements-années) étaient : évènements indésirables (39,5 ; 42,4 ; 27,7 ; 38,4) ; évènements indésirables graves (22,4 ; 25,1 ; 16,4 ; 22,2) ; décès imputables au traitement en relation avec la survenue de pneumonies (1,8 ; 1,5 ; 0,9 ; 1,4) respectivement.
Dans une analyse groupée de 11 études menées dans l'asthme (7 034 patients), l'incidence des pneumonies était de 18,4/1000 patient-années dans le groupe FF/VI 184/22 microgrammes contre 9,6/1000 patient-années dans le groupe FF/VI 92/22 microgrammes et 8,0/1000 patient-années dans le groupe placebo.
**Fractures
Dans deux études de 12 mois menées sur un total de 3 255 patients atteints de BPCO, l'incidence des fractures osseuses était faible au global dans tous les groupes de traitement, avec une incidence plus élevée dans tous les groupes Relvar Ellipta (2%) par rapport aux groupes vilantérol 22 microgrammes (<1 %). Bien qu'il y ait plus de fractures dans les groupes Relvar Ellipta comparativement au groupe vilantérol 22 microgrammes, les fractures typiques de l'utilisation de corticoïdes (telles que compression médullaire/fracture vertébrale thoraco-lombaire, fracture de la hanche et du cotyle) sont survenues chez <1% des patients dans les bras de traitement Relvar Ellipta et vilantérol.
Pour l’étude SUMMIT, l’incidence des fractures avec FF/VI, FF, VI et placebo étaient de 2% dans chaque groupe de traitement ; l’incidence des fractures typiquement associées à l’utilisation de CSI étaient inférieures à 1% dans chaque groupe de traitement. Les taux ajustés en fonction de l’exposition (pour 1000 traitements-années) pour toutes les fractures étaient respectivement de 13,6 ; 12,8 ; 13,2 ; 11,5. Les fractures typiquement associées à l’utilisation de CSI étaient respectivement de 3,4 ; 3,9 ; 2,4 ; 2,1.
Dans une analyse groupée de 11 études dans l'asthme (7 034 patients), l'incidence des fractures était <1%, et le plus souvent associé à un traumatisme.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration :
Belgique | Luxembourg |
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHÉ
GlaxoSmithKline Trading Services Limited
12 Riverwalk
Citywest Business Campus
Dublin 24
Irlande
D24 YK11
8. NUMÉRO(S) D’AUTORISATION DE MISE SUR LE MARCHÉ
EU/1/13/886/001
EU/1/13/886/002
EU/1/13/886/003
10. DATE DE MISE À JOUR DU TEXTE
12 mars 2025 (version 19)
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments http://www.ema.europa.eu.
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 3090214 | RELVAR ELLIPTA 92/22MCG PULV INHAL MULTIDOSE 1X30 | R03AK10 | € 51,09 | - | Oui | € 12,67 | € 7,53 |
| 3343738 | RELVAR ELLIPTA 92/22MCG PULV INHAL MULTIDOSE 3X30 | R03AK10 | € 110,08 | - | Oui | € 12,8 | € 8,5 |