1. DÉNOMINATION DU MÉDICAMENT
Seebri Breezhaler 44 microgrammes, poudre pour inhalation en gélules
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque gélule contient 63 microgrammes de bromure de glycopyrronium équivalant à 50 microgrammes de glycopyrronium.
Chaque dose délivrée au travers de l’embout buccal de l’inhalateur est de 55 microgrammes de bromure de glycopyrronium équivalant à 44 microgrammes de glycopyrronium.
Excipient(s) à effet notoire :
Chaque gélule contient 23,6 mg de lactose (sous forme de monohydrate).
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Poudre pour inhalation en gélule (poudre pour inhalation)
Gélules transparentes de couleur orange contenant une poudre blanche et portant le code produit « GPL 50 » imprimé en noir au-dessus d’une ligne noire et le logo de la société (![]() ) imprimé en noir sous la ligne.
) imprimé en noir sous la ligne.
4. INFORMATIONS CLINIQUES
4.1 Indications thérapeutiques
Seebri Breezhaler est indiqué chez l’adulte en traitement bronchodilatateur continu pour soulager les symptômes de la broncho-pneumopathie chronique obstructive (BPCO).
4.2 Posologie et mode d'administration
Posologie
La dose recommandée est l’inhalation du contenu d’une gélule une fois par jour à l’aide de l’inhalateur Seebri Breezhaler.
Il est recommandé d’administrer Seebri Breezhaler à la même heure chaque jour. En cas d’omission d’une dose, la dose suivante doit être prise le plus tôt possible. Les patients seront avertis qu’ils ne doivent pas prendre plus d’une dose par jour.
Populations particulières
Sujets âgés
Seebri Breezhaler peut être utilisé à la dose recommandée chez les sujets âgés (75 ans et plus) (voir rubrique 4.8).
Insuffisance rénale
Seebri Breezhaler peut être utilisé à la dose recommandée chez les patients atteints d’insuffisance rénale légère à modérée. En cas d’insuffisance rénale sévère ou en phase terminale nécessitant une dialyse, Seebri Breezhaler ne doit être utilisé que si le bénéfice attendu pour le patient est supérieur au risque potentiel car l’exposition systémique au glycopyrronium peut augmenter dans cette population (voir rubriques 4.4 et 5.2).
Insuffisance hépatique
Aucune étude n’a été conduite chez les patients atteints d’insuffisance hépatique. Le glycopyrronium étant éliminé essentiellement par voie rénale, il n’est pas attendu d’augmentation importante de l’exposition systémique chez ces patients. Aucun ajustement de dose n’est requis chez les patients présentant une insuffisance hépatique.
Population pédiatrique
Il n’existe pas d’utilisation justifiée de Seebri Breezhaler dans la population pédiatrique (en dessous de 18 ans) dans l’indication de la BPCO.
Mode d'administration
Voie inhalée.
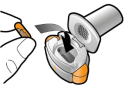
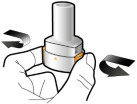
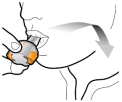
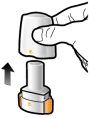
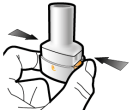
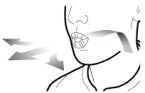
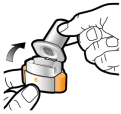
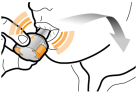
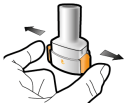
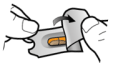
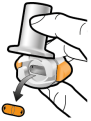
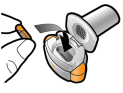
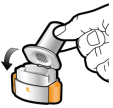
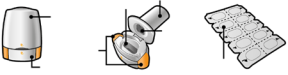
Les gélules doivent être exclusivement administrées à l’aide de l’inhalateur Seebri Breezhaler (voir rubrique 6.6).
Les gélules ne doivent être retirées de la plaquette qu’immédiatement avant leur utilisation.
Les gélules ne doivent pas être avalées.
Les patients doivent recevoir les instructions adaptées pour une utilisation correcte du dispositif et l'administration du médicament. En cas de non amélioration des symptômes respiratoires par le traitement, il convient de vérifier que le patient n’avale pas la gélule au lieu de l’utiliser en inhalation à l’aide du dispositif d’inhalation.
Pour les instructions concernant l’utilisation du médicament avant administration, voir la rubrique 6.6.
4.3 Contre-indications
Hypersensibilité à la substance active ou à l'un des excipients mentionnés à la rubrique 6.1.
4.8 Effets indésirables
Synthèse du profil de sécurité
L’effet indésirable anticholinergique le plus fréquent est une sécheresse buccale (2,4%). La majorité des cas de sécheresse buccale rapportés ont été considérés comme possiblement liés au médicament et bénins, aucun cas sévère n’a été rapporté.
Les autres effets anticholinergiques rapportés peu fréquemment sont la rétention urinaire. Des effets gastro-intestinaux incluant gastro-entérite et dyspepsie ont également été observés. Les effets indésirables en rapport avec la tolérance locale ont été : irritation de la gorge, rhinopharyngite, rhinite et sinusite.
Résumé tabulé des effets indésirables
Les effets indésirables rapportés pendant les six premiers mois des deux études pivots de phase III conduites individuellement sur une durée de 6 et 12 mois sont présentés par classe de système d’organes MedDRA (Tableau 1). Dans chaque classe de système d’organe, les effets indésirables sont présentés suivant un ordre décroissant de fréquence. Dans chaque groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de gravité. De plus, pour chaque effet indésirable, la fréquence de survenue correspondante est présentée selon la convention suivante : très fréquent (≥1/10) ; fréquent (≥1/100, <1/10) ; peu fréquent (≥1/1 000, <1/100) ; rare (≥1/10 000, <1/1 000) ; très rare (<1/10 000) ; fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Tableau 1 Effets indésirables
Effets indésirables | Catégorie de fréquence de survenue |
Infections et infestations |
|
Nasopharyngite1) | Fréquent |
Rhinite | Peu fréquent |
Cystite | Peu fréquent |
|
|
Affections du système immunitaire |
|
Hypersensibilité | Peu fréquent |
Angioedème2) | Peu fréquent |
|
|
Troubles du métabolisme et de la nutrition |
|
Hyperglycémie | Peu fréquent |
|
|
Affections psychiatriques |
|
Insomnie | Fréquent |
|
|
Affections du système nerveux |
|
Céphalée3) | Fréquent |
Hypoesthésie | Peu fréquent |
|
|
Affections cardiaques |
|
Fibrillation auriculaire | Peu fréquent |
Palpitations | Peu fréquent |
|
|
Affections respiratoires, thoraciques et médiastinales |
|
Congestion au niveau des sinus | Peu fréquent |
Toux productive | Peu fréquent |
Irritation de la gorge | Peu fréquent |
Epistaxis | Peu fréquent |
Dysphonie2) | Peu fréquent |
Bronchospasme paradoxal2) | Fréquence inconnue |
|
|
Affections gastro-intestinales |
|
Sécheresse buccale | Fréquent |
Gastro-entérite | Fréquent |
Vomissements1)2) | Peu fréquent |
Dyspepsie | Peu fréquent |
Caries dentaires | Peu fréquent |
|
|
Affections de la peau et du tissu sous-cutané |
|
Eruption cutanée | Peu fréquent |
Prurit2) | Peu fréquent |
|
|
Affections musculo‑squelettiques et systémiques |
|
Douleurs musculo-squelettiques1)2) | Fréquent |
Douleurs des extrémités | Peu fréquent |
Douleur thoracique musculo‑squelettique | Peu fréquent |
|
|
Affections du rein et des voies urinaires |
|
Infection urinaire3) | Fréquent |
Dysurie | Peu fréquent |
Rétention urinaire | Peu fréquent |
|
|
Troubles généraux et anomalies au site d’administration |
|
Sensation de fatigue | Peu fréquent |
Asthénie | Peu fréquent |
1) Plus fréquent avec le glycopyrronium qu’avec le placebo uniquement dans la base de données de 12 mois
2) Des cas ont été observés depuis la commercialisation de Seebri Breezhaler. Ces cas sont issus de notifications spontanées sans information sur la population totale exposée ce qui rend impossible l'estimation précise de la fréquence de survenue de cet effet indésirable. Par conséquent, la fréquence de survenue présentée a été calculée à partir des données issues des essais cliniques.
3) Observé plus fréquemment avec le glycopyrronium qu’avec le placebo chez le sujet âgé >75 ans uniquement
Description spécifique des effets indésirables :
Dans la base regroupant les données à 6 mois, la fréquence de la sécheresse buccale a été respectivement de 2,2% avec Seebri Breezhaler versus 1,1% avec le placebo, celle de l’insomnie de 1,0% versus 0,8% et celle de la gastro-entérite de 1,4% versus 0,9%.
La sécheresse buccale a été rapportée essentiellement pendant les 4 premières semaines de traitement, avec une durée médiane de 4 semaines chez la majorité des patients. Dans 40% des cas toutefois, les symptômes ont persisté pendant la période complète de 6 mois. Aucun nouveau cas de sécheresse buccale n’a été rapporté pendant les mois 7 à 12.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via:
Belgique
Agence fédérale des médicaments et des produits de santé
www.afmps.be
Division Vigilance:
Site internet: www.notifieruneffetindesirable.be
e-mail: adr@fagg-afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy
ou Division de la pharmacie et des médicaments de la Direction de la santé
Site internet: www.guichet.lu/pharmacovigilance
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHÉ
Novartis Europharm Limited
Vista Building
Elm Park, Merrion Road
Dublin 4
Irlande
8. NUMÉRO(S) D'AUTORISATION DE MISE SUR LE MARCHÉ
EU/1/12/788/001-008
10. DATE DE MISE À JOUR DU TEXTE
06.08.2025
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments http://www.ema.europa.eu
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 2992766 | SEEBRI BREEZHALER 44 MCG PULV INHAL CAPS 90 UD | R03BB06 | € 101,6 | - | Oui | € 15,5 | € 10,2 |
| 2992774 | SEEBRI BREEZHALER 44 MCG PULV INHAL CAPS 30 UD | R03BB06 | € 42,9 | - | Oui | € 10,8 | € 6,42 |