1. DENOMINATION DU MEDICAMENT
Microgynon 20®,100 microgrammes/20 microgrammes comprimés enrobés
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Un comprimé contient 100 microgrammes de lévonorgestrel et 20 microgrammes d’éthinylestradiol.
Excipients à effet notoire : lactose 35 mg, saccharose 19 mg.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Comprimé enrobé
Comprimé enrobé rose, rond, convexe.
4. DONNEES CLINIQUES
4.1 Indications thérapeutiques
Contraception orale.
La décision de prescrire Microgynon 20 doit être prise en tenant compte des facteurs de risque de la patiente, notamment ses facteurs de risque de thrombo-embolie veineuse (TEV), ainsi que du risque de TEV associé à Microgynon 20 en comparaison aux autres CHC (Contraceptifs Hormonaux Combinés) (voir rubriques 4.3 et 4.4).
4.2 Posologie et mode d’administration
Mode d’administration
Voie orale
Posologie
Comment prendre Microgynon 20
Les comprimés doivent être pris dans l’ordre indiqué sur l’emballage de la plaquette, environ à la même heure chaque jour, avec un peu de liquide si nécessaire. Prendre un comprimé par jour pendant 21 jours consécutifs. Chaque plaquette est entamée après une période de 7 jours sans comprimés, au cours de laquelle une hémorragie de privation survient habituellement. Le saignement débute habituellement 2 à 3 jours après la prise du dernier comprimé et ne se termine pas nécessairement avant le début de la plaquette suivante.
Comment commencer Microgynon 20
- Aucune contraception hormonale antérieure (au cours du dernier mois)
La prise des comprimés doit débuter le premier jour du cycle naturel de la femme (= le premier jour de ses règles).
Elle peut éventuellement débuter aux jours 2 à 5, mais dans ce cas une méthode contraceptive mécanique supplémentaire est recommandée au cours des 7 premiers jours du premier cycle.
- Relais d’un autre contraceptif hormonal combiné (contraceptif oral combiné (COC), anneau vaginal, dispositif transdermique)
La femme doit commencer Microgynon 20 le lendemain de la prise du dernier comprimé contenant des hormones du COC précédent, mais au plus tard le jour qui suit la fin de la période habituelle sans comprimés ou le lendemain de la prise du dernier comprimé sans hormones du contraceptif hormonal précédent. En cas d’utilisation d’un anneau vaginal ou d’un dispositif transdermique, la femme doit de préférence commencer Microgynon 20 le jour du retrait, mais au plus tard le jour où l’anneau ou le dispositif suivant aurait dû être appliqué.
- Relais d’une contraception utilisant un progestatif seul (pilule, injection, implant) ou d’un dispositif intra-utérin (DIU)
La femme peut débuter Microgynon 20 à n’importe quel moment à partir d’une micropilule (pour un implant ou un DIU, le jour de son retrait ; pour un contraceptif injectable, le jour où l’injection suivante aurait dû avoir lieu), mais il convient dans tous les cas de lui conseiller d’utiliser une méthode contraceptive supplémentaire mécanique pendant les 7 premiers jours de la prise des comprimés.
- Après un avortement du premier trimestre
La prise des comprimés peut débuter immédiatement. Dans ce cas, aucune autre mesure contraceptive n’est nécessaire.
- Après un accouchement ou un avortement du 2ème trimestre
Pour l’allaitement maternel, voir rubrique 4.6, Fécondité, grossesse et allaitement.
La prise des comprimés débutera 21 à 28 jours après l’accouchement ou l’avortement du 2ème trimestre. Si elle débute plus tardivement, une méthode mécanique supplémentaire doit être utilisée pendant les 7 premiers jours de la prise des comprimés. Si la femme a déjà eu des rapports sexuels, il convient d’exclure une grossesse avant de commencer le COC actuel ou la femme devra attendre ses prochaines règles.
Conduite à tenir en cas d’oubli d’un ou plusieurs comprimés :
Les concentrations des deux hormones contenues dans Microgynon 20 sont très faibles. En conséquence, la marge d’efficacité contraceptive est faible en cas d’oubli d’un comprimé. Si la femme a un retard de moins de 12 heures pour la prise d’un comprimé, l’efficacité contraceptive n’est pas diminuée. Elle doit prendre le comprimé dès qu’elle s’en rend compte et prendre les comprimés suivants à l’heure habituelle.
Si elle a un retard de plus de 12 heures pour la prise d’un comprimé, la sécurité contraceptive peut être réduite. Les deux règles de base suivantes sont applicables en cas d’oubli de comprimés :
- La prise des comprimés ne doit jamais être interrompue pendant plus de 7 jours.
- Une suppression efficace de l’axe hypothalamo-hypophyso-ovarien nécessite une prise ininterrompue des comprimés pendant 7 jours.
Par conséquent, les conseils suivants peuvent être donnés pour la pratique quotidienne :
Semaine 1
La femme doit prendre le dernier comprimé oublié dès qu’elle s’en rend compte, même si cela implique la prise de deux comprimés en même temps. Elle continuera ensuite à prendre les comprimés suivants à l’heure habituelle. En outre, elle devra utiliser une contraception mécanique supplémentaire, des préservatifs par exemple, au cours des 7 jours qui suivent. Si des rapports sexuels ont eu lieu au cours des 7 jours qui précèdent l’oubli du comprimé, il existe un risque de grossesse. Plus le nombre de comprimés oubliés est important et plus l’on est proche de la période d’interruption sans comprimés, plus le risque de grossesse augmente.
Semaine 2
La femme doit prendre le dernier comprimé oublié dès qu’elle s’en rend compte, même si cela implique de prendre deux comprimés en même temps. Elle continuera ensuite à prendre les comprimés suivants à l’heure habituelle. Si la femme a correctement pris ses comprimés au cours des 7 jours qui précèdent le premier comprimé oublié, aucune mesure contraceptive supplémentaire n’est nécessaire. Si elle n’a pas correctement pris ses comprimés ou si elle a oublié plusieurs comprimés, il faut recommander des précautions contraceptives supplémentaires pendant les 7 jours qui suivent.
Semaine 3
Le risque de moindre fiabilité contraceptive est important parce que l’on se rapproche de la période de 7 jours sans comprimés. Il est cependant possible d’éviter la réduction de la protection contraceptive par un ajustement de la dose. Si l’on se conforme aux recommandations suivantes, il n’est pas nécessaire de recourir à des précautions contraceptives supplémentaires, à condition que tous les comprimés aient été pris correctement au cours des 7 jours qui précèdent le premier comprimé oublié. Si ce n’est pas le cas, la femme devra se conformer à la première de ces deux options et il lui faudra également recourir à des précautions contraceptives supplémentaires pendant les 7 jours qui suivent.
- La femme doit prendre le dernier comprimé oublié dès qu’elle s’en rend compte, même si cela implique de prendre deux comprimés en même temps. Elle continuera ensuite à prendre les comprimés suivants à l’heure habituelle. La plaquette suivante est entamée aussitôt après avoir terminé la plaquette en cours, donc sans arrêt entre deux plaquettes. Il n’apparaîtra probablement pas d’hémorragie de privation avant la fin de la seconde plaquette, mais il est possible que la femme constate du spotting ou des métrorragies au cours des jours de prise des comprimés.
- Il est également possible de cesser la prise des comprimés de la plaquette en cours. La femme doit alors respecter un arrêt de 7 jours maximum sans prendre aucun comprimé, incluant les jours où des comprimés ont été oubliés, puis continuer en entamant la plaquette suivante.
Si la femme a oublié plusieurs comprimés et ne présente pas d’hémorragie de privation pendant le premier intervalle normal sans comprimés, il convient d’envisager l’éventualité d’une grossesse.
Conseils en cas de troubles gastro-intestinaux
En cas de symptômes gastro-intestinaux sévères, une absorption incomplète des principes actifs est possible et des mesures contraceptives supplémentaires doivent donc être prises.
Si des vomissements ou une diarrhée sévère surviennent dans les 3 à 4 heures qui suivent la prise d’un comprimé, la femme doit appliquer les conseils donnés en cas d’oubli d’un comprimé. Si la femme ne veut pas modifier son schéma normal de prise des comprimés, elle devra prendre les comprimés supplémentaires dans une autre plaquette.
Comment modifier le premier jour des règles ou retarder les règles
Pour retarder la survenue des règles, la femme doit commencer une nouvelle plaquette immédiatement après avoir terminé la plaquette précédente, sans interruption. Les règles peuvent être retardées aussi longtemps qu’on le souhaite, mais jamais au-delà de la fin de la seconde plaquette. Au cours de cette période, la femme peut présenter des métrorragies ou des spotting. Microgynon 20 peut ensuite être repris de façon régulière après la période habituelle de 7 jours sans comprimés.
Si la femme souhaite décaler le premier jour de ses règles à un autre jour de la semaine, on peut lui conseiller de raccourcir la prochaine période d’interruption sans comprimés du nombre de jours souhaité. Plus on raccourcit la phase d’interruption, plus le risque d’absence d’hémorragie de privation augmente et plus la femme risque de présenter une métrorragie ou un spotting pendant l’utilisation de la plaquette suivante (exactement comme lorsque l’on retarde les règles).
Informations supplémentaires relatives à des populations particulières
Population pédiatrique
Microgynon 20 n’est indiqué qu’après les premières règles.
Population gériatrique
Sans objet. Microgynon 20 n’est pas indiqué après la ménopause.
Patientes atteintes d’insuffisance hépatique
Microgynon 20 est contre-indiqué chez les femmes souffrant d’une maladie hépatique grave. Voir aussi rubrique 4.3.
Patientes atteintes d’insuffisance rénale
Microgynon 20 n’a pas fait l’objet d’études spécifiques chez des patientes souffrant de troubles de la fonction rénale. D’après les données disponibles, il n’est pas nécessaire d’adapter le traitement dans cette population de patientes.
4.3 Contre-indications
Les contraceptifs hormonaux combinés (CHC) ne doivent pas être utilisés dans les situations suivantes. Si l’une d’entre elles devait apparaître pour la première fois au cours de l’utilisation du CHC, le produit doit être arrêté immédiatement.
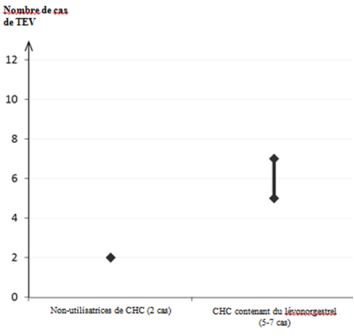
- Présence ou risque de thrombo-embolie veineuse (TEV)
- Thrombo-embolie veineuse – présence de TEV (patient traité par des anticoagulants) ou antécédents de TEV (p. ex. thrombose veineuse profonde [TVP] ou embolie pulmonaire [EP])
- Prédisposition connue, héréditaire ou acquise, à la thrombo-embolie veineuse, telle qu’une résistance à la protéine C activée (PCa) (y compris une mutation du facteur V de Leiden), un déficit en antithrombine III, un déficit en protéine C, un déficit en protéine S
- Intervention chirurgicale majeure avec immobilisation prolongée (voir rubrique 4.4)
- Risque élevé de thrombo-embolie veineuse dû à la présence de multiples facteurs de risque (voir rubrique 4.4)
- Présence ou risque de thrombo-embolie artérielle (TEA)
- Thrombo-embolie artérielle – présence ou antécédents de thrombo-embolie artérielle (p. ex. infarctus du myocarde [IM]) ou de prodromes (p. ex. angine de poitrine)
- Affection cérébrovasculaire – présence ou antécédents d’accident vasculaire cérébral (AVC) ou de prodromes (p. ex. accident ischémique transitoire [AIT])
- Prédisposition connue, héréditaire ou acquise, à la thrombo-embolie artérielle, telle qu’une hyperhomocystéinémie ou la présence d’anticorps anti-phospholipides (anticorps anti-cardiolipine, anticoagulant lupique).
- Antécédents de migraine avec signes neurologiques focaux
- Risque élevé de thrombo-embolie artérielle dû à la présence de multiples facteurs de risque (voir rubrique 4.4) ou d’un facteur de risque sévère tel que :
- diabète avec symptômes vasculaires
- hypertension artérielle sévère
- dyslipoprotéinémie sévère
- Présence ou antécédents de troubles hépatiques sévères, aussi longtemps que les paramètres de la fonction hépatique ne sont pas revenus à la normale ;
- Présence ou antécédents de tumeurs hépatiques, bénignes ou malignes;
- Tumeurs malignes dépendant des stéroïdes sexuels, diagnostiquées ou suspectées (exemple: des organes génitaux ou des seins) ;
- Hémorragie vaginale non diagnostiquée ;
- Aménorrhée d’étiologie inconnue ;
- Hypersensibilité aux substances actives lévonorgestrel, éthinylestradiol ou à l’un des excipients mentionnés à la rubrique 6.1.
Microgynon 20 est contre-indiqué en administration concomitante avec des médicaments contenant l’association ombitasvir/paritaprévir/ritonavir et le dasabuvir, des médicaments contenant le glécaprévir/pibrentasvir ou le sofosbuvir/velpatasvir/voxilaprévir (voir rubrique 4.5).
4.8 Effets indésirables
Résumé du profil de sécurité
Les effets indésirables les plus fréquents associés à l’utilisation de Microgynon 20 sont les suivants : nausées, douleurs abdominales, prise de poids, céphalées, humeur dépressive, sautes d’humeur, douleurs mammaires, tension mammaire. Ils touchent ≥ 1% à < 10% des utilisatrices.
Les effets indésirables graves sont la thrombo-embolie artérielle et la thrombo-embolie veineuse.
Tableau des effets indésirables
Les effets indésirables sont groupés par fréquence. Les groupes de fréquence sont définis comme suit : fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1 000 à < 1/100), rare (≥ 1/10 000 à < 1/1 000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles). Les autres effets indésirables décrits chez les utilisatrices de contraceptifs hormonaux combinés dont Microgynon 20 sont * :
Système / organe (MedDRA) | Fréquent | Peu fréquent | Rare | Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) |
Affections du système immunitaire |
|
| Hypersensibilité | Exacerbation des symptômes d'un angio-oedème héréditaire et acquis |
Troubles du métabolisme et de la nutrition |
| Rétention hydrique |
|
|
Affections psychiatriques | Humeur dépressive, Troubles de l’humeur | Diminution de la libido | Augmentation de la libido |
|
Affections du système nerveux | Céphalée | Migraine |
|
|
Affections oculaires |
|
| Intolérance aux lentilles de contact |
|
Affections vasculaires |
|
| Thrombo-embolie veineuse (TEV) |
|
Affections gastro-intestinales | Nausées, | Vomissements, |
|
|
Affections de la peau et du tissu sous-cutané |
| Rash, | Érythème nodulaire, Érythème polymorphe |
|
Affections des organes de reproduction et du sein | Tension mammaire, Douleurs mammaires | Augmentation du volume des seins | Écoulement mammaire, Perte vaginale |
|
Investigations | Prise de poids |
| Perte de poids |
|
* Le terme MedDRA le plus approprié (version 12.0) est listé pour décrire un certain effet indésirable. Les synonymes ou les affections voisines ne sont pas listés mais doivent également être pris en considération.
Description de certains effets indésirables particuliers
Une augmentation du risque d'événement thrombotique et thrombo-embolique artériel et veineux, incluant l’infarctus du myocarde, l’AVC, les accidents ischémiques transitoires, la thrombose veineuse et l’embolie pulmonaire, a été observée chez les femmes utilisant des CHC ; ceci est abordé plus en détail en rubrique 4.4.
Les effets indésirables dont la fréquence est très faible ou dont les symptômes sont d’apparition tardive et qui sont considérés comme associés au groupe des contraceptifs oraux combinés sont décrits ci-dessous (voir aussi rubriques 4.3 et 4.4) :
Tumeurs
- La fréquence de diagnostic du cancer du sein est légèrement accrue chez les femmes utilisant des COC. Étant donné que le cancer du sein est rare chez les femmes de moins de 40 ans, l’augmentation est faible par rapport au risque global de cancer du sein. On ne sait pas si les COC en sont la cause. Pour plus d’information, voir rubriques 4.3 et 4.4.
- Tumeurs hépatiques (bénignes ou malignes).
Autres affections
- Risque accru de pancréatite chez les femmes atteintes d’hypertriglycéridémie.
- Hypertension artérielle.
- Apparition ou aggravation d’affections dont le lien avec l’utilisation d’un COC n’est pas établi avec certitude : ictère et/ou prurit associés à une cholestase ; lithiase biliaire ; porphyrie ; lupus érythémateux disséminé ; syndrome hémolytique et urémique ; chorée de Sydenham ; herpes gestationis ; perte d’audition liée à une otosclérose.
- Troubles de la fonction hépatique.
- Modifications de la tolérance au glucose ou effet sur la résistance périphérique à l’insuline.
- Maladie de Crohn, rectocolite hémorragique.
- Chloasma.
Interactions
Une hémorragie intercurrente et/ou un échec de la contraception peuvent résulter d’interactions entre d’autres médicaments (inducteurs enzymatiques) et les contraceptifs oraux (voir rubrique « Interactions avec d’autres médicaments et autres interactions »).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration.
Belgique:
Agence Fédérale des Médicaments et des Produits de Santé
www.afmps.be
Division Vigilance
Site internet: www.notifieruneffetindesirable.be
e-mail: adr@fagg-afmps.be
Luxembourg:
Centre Régional de Pharmacovigilance de Nancy
ou Division de la pharmacie et des médicaments de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 2314235 | MICROGYNON 20 DRAG 3 X 21 | G03AA07 | € 18,31 | - | Oui | € 9,31 | € 9,31 |