RESUME DES CARACTERISTIQUES DU PRODUIT
1. DENOMINATION DU MEDICAMENT
DEXA-RHINOSPRAY DEXAMETHASONE/TRAMAZOLINE 0,29 mg/ml + 1,72 mg/ml, suspension pour pulvérisation nasale
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chlorhydrate de tramazoline 0,12 mg - Dexaméthasone isonicotinate 0,02 mg- par nébulisation
Excipients à effet notoire :
Chlorure de benzalkonium: 12 microgrammes par nébulisation, équivalent à 0,15 mg/ml suspension (voir rubrique 4.4)
Alcool benzylique: 0,2 mg par nébulisation, équivalent à 2,5 mg/ml suspension (voir rubrique 4.4)
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Suspension pour pulvérisation nasale
4. DONNEES CLINIQUES
4.1 Indications thérapeutiques
DEXA-RHINOSPRAY DEXAMETHASONE/TRAMAZOLINE est indiqué chez les adultes et enfants à partir de 7 ans pour le traitement symptomatique de courte durée des rhinites inflammatoires, notamment allergiques, y compris le rhume des foins.
En premier lieu, il est recommandé de rincer le nez avec une solution saline. Lorsque la congestion nasale persiste après rinçage du nez, DEXA-RHINOSPRAY DEXAMETHASONE/TRAMAZOLINE peut être utilisé.
4.2 Posologie et mode d’administration
Posologie:
On utilisera le DEXA-RHINOSPRAY DEXAMETHASONE/TRAMAZOLINE avec modération, vu son action prolongée et intense.
Après s'être mouché, agiter le flacon et pratiquer 1 nébulisation dans chaque narine 2 à 3 fois par jour.
L’administration peut être répétée jusqu’à un maximum de 6 prises par 24 heures pour les adultes.
DEXA-RHINOSPRAY DEXAMETHASONE/TRAMAZOLINE peut être utilisé pendant maximum 5 jours consécutifs.
Population pédiatrique
Chez l'enfant on ne dépassera pas :
- 4 nébulisations par 24 heures (7 à 9 ans)
- 5 nébulisations par 24 heures (10 à 12 ans)
- 6 nébulisations par 24 heures (à partir de 13 ans).
Le DEXA-RHINOSPRAY DEXAMETHASONE/TRAMAZOLINE ne convient qu'aux adultes et enfants à partir de 7 ans.
Il convient d'administrer la dose la plus faible possible pour laquelle on obtient un soulagement des symptômes.
Le mode d'administration et la durée du traitement seront déterminés dans chaque cas par le médecin.
Mode d'administration:
- Bien agiter le flacon.
- Retirer le capuchon protecteur de l’embout nasal.
Activer la pompe lors de la première utilisation. Pour activer la pompe, tenir le flacon avec le pouce sur le fond flacon, l’index et le majeur sur l’anneau entourant l’embout. S’assurer que le flacon pointe vers le haut et loin des yeux. Presser la pompe 7 x avec votre pouce, fermement et rapidement. La pompe est maintenant activée et peut être utilisée.
Si la pompe n’est plus utilisée depuis plus de 24 heures, il est également recommandé d’activer la pompe jusqu’à ce que le spray soit libéré. (fig. 1) - Mouchez votre nez pour nettoyer vos narines, si nécessaire.
- Maintenir le flacon droit. Fermer une narine en pressant le doigt sur le côté. Incliner légèrement votre tête vers l’avant, introduire l’embout dans l’autre narine et vaporiser le spray latéralement ; presser fermement et rapidement vers le haut avec le pouce sur le fond du flacon, l’index et le majeur sur l’anneau entourant l’embout, en inspirant par le nez. (fig.2)
- Répéter cette opération dans l’autre narine.
- Ne pas moucher votre nez immédiatement après avoir utilisé le spray.
- Nettoyer régulièrement l’embout à l’eau chaude.
- Remettre le capuchon.
Schémas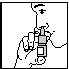
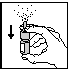
Fig. 1 Fig. 2
Agiter le flacon avant chaque emploi.
4.3 Contre-indications
- Hypersensibilité aux substances actives (au chlorhydrate de tramazoline ou au dexaméthasone isonicotinate) ou à l’un des excipients mentionnés à la rubrique 6.1.
- Mycoses nasales, tuberculose, atteintes virales (herpès, vaccin, varicelle ...), infections du nez, de la bouche, des yeux et/ou des voies respiratoires supérieures du fait de la composante corticoïde.
- Enfants de moins de 7 ans.
- Rhinite sèche.
- Glaucome, incluant glaucome à angle fermé (interaction théorique avec la composante sympathicomimétique).
Grossesse et lactation.
Après chirurgie crânienne via le nez.
4.8 Effets indésirables
L'usage prolongé de corticostéroïdes à des doses supérieures à celles recommandées peut mener à des effets systémiques.
Les effets indésirables ont été rapportés spontanément lors de l’utilisation post-marketing. La fréquence des effets indésirables n’a pas pu être estimée sur base des données disponibles et est par conséquent classée comme « fréquence indéterminée ».
Affections du système immunitaire: hypersensibilité, infections masquées (les signes d'une infection dans la sphère nez-gorge-oreilles peuvent être masqués).
Affections endocriniennes: hypercorticotisme, retard de croissance chez les enfants (voir rubrique 4.4).
Affections psychiatriques: hallucinations, insomnie, agitation.
Affections du système nerveux: céphalée, sédation, somnolence, vertiges, dysgeusie (trouble du goût).
Affections oculaires: élévation de la pression intraoculaire, vision floue, choriorétinopathie (voir rubrique 4.4).
Affections cardiaques: palpitations, tachycardie, augmentation de la pression sanguine, arythmie cardiaque.
Affections respiratoires, thoraciques et médiastinales: congestion nasale par hyperémie réactionnelle et rhinite iatrogène; ulcération et perforation de la cloison nasale, epistaxis, œdème nasal, gène nasale, sécheresse nasale, rhinorrhée, éternuement et irritation de la gorge.
Affections de la peau et du tissu sous-cutané : rash, prurit, urticaire, hyperhidrose.
Affections gastro-intestinales: nausées.
Troubles généraux et anomalies au site d'administration: fatigue.
Investigations: élévation de la pression sanguine.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration:
Belgique : Agence Fédérale des Médicaments et des Produits de Santé – Division Vigilance – Boîte Postale 97 – 1000 Bruxelles Madou – Site internet: www.notifieruneffetindesirable.be – E-mail : adr@afmps.be
Luxembourg : Centre Régional de Pharmacovigilance de Nancy –crpv@chru-nancy.fr – Tél. : (+33) 383 656085/87 OU Division de la Pharmacie et des Médicaments – Direction de la santé, Luxembourg – pharmacovigilance@ms.etat.lu – Tél. : (+352) 24785592 – Lien pour le formulaire : https://guichet.public.lu/fr/entreprises/sectoriel/sante/medecins/notification-effets-indesirables-medicaments.html
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
Sanofi Belgium
Leonardo Da Vincilaan 19
1831 Diegem
Tel.: 02/710.54.00
e-mail : info.belgium@sanofi.com
8. NUMERO D’AUTORISATION DE MISE SUR LE MARCHE
BE180354 / LU : 20100400765 / 0231638
10. DATE DE MISE A JOUR DU TEXTE
Date d’approbation : 02/2025
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 1281476 | DEXA RHINOSPRAY MICRODOSEUR 10 ML | R01AD53 | € 13,68 | - | Oui | - | - |